你可能感兴趣的试题
(g)和1L (g),在一定条件下发生下列反应: 3A(g)十B.(g)  nC(g)+2D(g) 达到平衡后,A.物质的量浓度减小1/2,混合气体的平均摩尔质量增大1/8,则该反应的化学方程式中n的值是( ) A.1B.2 3 4
nC(g)+2D(g) 达到平衡后,A.物质的量浓度减小1/2,混合气体的平均摩尔质量增大1/8,则该反应的化学方程式中n的值是( ) A.1B.2 3 4
T1<T2  T1℃时该反应的平衡常数为4.0L.2·mol-2 D
T1℃时该反应的平衡常数为4.0L.2·mol-2 D
t0 ~t1时间内υ(H2)=3 /(t1 - t0) mol·(L·min)-1 t1时,若升高温度或再充入CO2气体,都可以提高H2的转化率 t0时,v(正)>v(逆) T ℃时,平衡常数K = 1/27,CO2与H2的转化率相等
T1<T2 T1℃时该反应的平衡常数为4.0 L.2·mol-2 同一温度下,n(H2)/n(CO)越大,平衡常数也越大 相同条件下n(H2)/n(CO)越大,CO和H2的转化率也越大 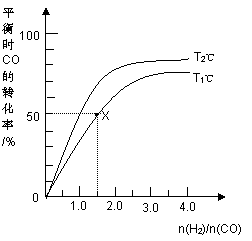
由反应①、②可知如图所示的热化学方程式为CO(g)+H2O(g)==== CO2(g)+H2(g)ΔH = -41.2 kJ·mol-1 H2的燃烧热为241.8 kJ·mol-1 H2(g)转变成H2O(g)的化学反应一定要释放能量 根据②推知反应H2(g)+1/2O2(g)==== H2O(l)ΔH > -241.8 kJ·mol-1
正、逆反应速率都等于零 HI、H2、I2的浓度相等 HI、H2、I2在容器中共存 HI、H2、I2的浓度均不再变化
HI的生成速率等于其分解速率
HI的生成速率小于其分解速率
HI的生成速率大于其分解速率
无法判断HI的生成速率和分解速率的相对大小
t0 ~t1时间内υ(H2)=3 /(t1 - t0) mol·(L·min)-1 t1时,若升高温度或再充入CO2气体,都可以提高H2的转化率 t0时,v(正)>v(逆) T ℃时,平衡常数K = 1/27,CO2与H2的转化率相等
物质发生化学反应时不一定都伴随着能量变化 一个化学反应中,当反应物总能量大于生成物总能量时,反应放热,ΔH.>0 在加热条件下发生的反应均为吸热反应 同温同压下,H2 (g) + Cl2(g) = 2HCl(g)在光照和点燃条件下的ΔH.相同
物质的量浓度减小1/2,混合 气体的平均摩尔质量增大1/8,则该反应的化学方程式中n的值是 ( ) A.1 2 3 4
异戊二烯( )与等物质的量的Br2发生加成反应 2-氯丁烷(CH3CHClCH2CH3)与NaOH乙醇溶液共热 甲苯在一定条件下发生硝化生成一硝基甲苯的反应 甲醇在铜催化和加热条件下生成的产物
)与等物质的量的Br2发生加成反应 2-氯丁烷(CH3CHClCH2CH3)与NaOH乙醇溶液共热 甲苯在一定条件下发生硝化生成一硝基甲苯的反应 甲醇在铜催化和加热条件下生成的产物

 nC(g)+2D(g) 达到平衡后,A.物质的量浓度减小1/2,混合气体的平均摩尔质量增大1/8,则该反应的化学方程式中n的值是( ) A.1B.2 3 4
nC(g)+2D(g) 达到平衡后,A.物质的量浓度减小1/2,混合气体的平均摩尔质量增大1/8,则该反应的化学方程式中n的值是( ) A.1B.2 3 4
 T1℃时该反应的平衡常数为4.0L.2·mol-2 D
T1℃时该反应的平衡常数为4.0L.2·mol-2 D

 )与等物质的量的Br2发生加成反应 2-氯丁烷(CH3CHClCH2CH3)与NaOH乙醇溶液共热 甲苯在一定条件下发生硝化生成一硝基甲苯的反应 甲醇在铜催化和加热条件下生成的产物
)与等物质的量的Br2发生加成反应 2-氯丁烷(CH3CHClCH2CH3)与NaOH乙醇溶液共热 甲苯在一定条件下发生硝化生成一硝基甲苯的反应 甲醇在铜催化和加热条件下生成的产物