你可能感兴趣的试题
图 1 比较 Zn和Fe的金属活动性强弱 图 2 探究铁钉生锈时,是否需要O2参与反应 图 3 比较红磷和白磷的着火点 图 4 测定空气中O2的含量
甲装置烧杯中盛放清水,在光照下测定O2释放量,乙装置在__下测定CO2释放量 甲装置烧杯中盛放清水,测定CO2释放量,乙装置换成CO2吸收剂测定O2消耗量 甲装置烧杯中盛放清水,测定气体体积变化量,乙装置换成CO2吸收剂,测定O2消耗量 甲装置烧杯中盛放CO2缓冲剂(可吸收和放出CO2),测定氧气消耗量,乙装置放死亡种子作对照
装置甲:测定合金中Zn的含量 装置乙:制取金属锰 装置丙:洗气除去SO2中的CO2 装置丁:实验室制取O2
用在O2中燃烧的方法除去CO2中少量的CO 做铁在O2中燃烧实验中,集气瓶应预先放少量水或细沙 配制稀硫酸时,将蒸馏水沿烧杯内壁慢慢倒入盛浓硫酸的烧杯中 用金属和酸制取H2时,可采用与CO2相同的收集装置
验证NaCl溶液中混有盐酸取少量溶液,滴加无色酚酞溶液 鉴别O2和N2伸入带火星的木条 除去铁制品上的铁锈将铁制品浸泡在足量的稀硫酸中 除去氢氧化钠中混有的碳酸钠滴加适量石灰水,过滤
图 1 比较 Zn 和 Fe 的金属活动性强弱 图 2 探究铁钉生锈时 O2 是否参与反应
图 3 比较红磷和白磷的着火点 图 4 测定空气中 O2 的含量
图1比较Zn和Fe的金属活动性强弱 图2探究铁钉生锈时O2是否参与反应 图3比较红磷和白磷的着火点 图4测定空气中O2的含量
Q1>Q3>Q2 =78.8kJ 三个容器中反应的平衡常数均为K=2 甲中反应达到平衡时,若升高温度,则SO2的转化率将大于50% 若乙容器中的反应经tmin达到平衡,则0~tmin内,v(O2)=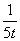 mol/(L.·min)
mol/(L.·min)
图甲比较铁、铜的金属活动性强弱 图乙探究金属的锈蚀是否需要水 图丙探究MnO2对H2O2分解的催化作用 图丁探究可燃物的燃烧是否需要达到一定温度
实验Ⅰ:静置一段时间,小试管内有晶体析出 实验Ⅱ:制取O2 实验Ⅲ:除CO2气体中的HCl 实验Ⅳ:配制一定物质的量浓度的稀硫酸
洗涤用高锰酸钾制O2后的试管,溶液常呈红色 滴有稀H2SO4的pH试纸呈红色 碳在O2中燃烧发白光 向CaCl2溶液中通入足量CO2气体,出现大量白色沉淀
排空气法收集NO 乙醇萃取碘水中碘 过滤 量取9.3mLH2O
分离碘和酒精 除去CO2中的HCl 实验室制氨气 排水法收集NO
实验目的:除去CO2中的CO;实验操作:点燃
实验目的:除去CaO中的CaCO3;实验操作:加水溶解并过滤
实验目的:区分羊毛与合成纤维;实验操作:点燃,闻气味
实验目的:区分稀盐酸和稀硫酸;实验操作:滴加紫色石蕊溶液
△H.<0 △S.<0 化学能转变为电能 氢能是理想的绿色能源
甲装置烧杯中盛放清水,在光照下测定O2释放量,乙装置在__下测定CO2释放量 甲装置烧杯中盛放清水,测定CO2释放量,乙装置换成CO2吸收剂测定O2消耗量 甲装置烧杯中盛放清水,测定气体体积变化量,乙装置换成CO2吸收剂测定O2消耗量 甲装置烧杯中盛放CO2缓冲剂(可吸收和放出CO2),测定气体体积变化量,乙装置换成CO2吸收剂,测定O2消耗量
用图1装置制取并收集干燥纯净的NH3 用图2所示装置可除去NO2中的NO 用图3所示装置检验装置的气密性 图④是实验室洗涤胶头滴管的操作
选用红磷是因为反应可以耗尽O2,生成固态的P2O5 燃烧匙中的红磷可以换成硫或木炭 燃烧匙中的红磷越多,水位上升越高 本实验可以证明空气含有N2、O2、CO2和稀有气体

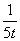 mol/(L.·min)
mol/(L.·min)