你可能感兴趣的试题
负极反应式为CH4 + 10OH--8e-=== CO32-+ 7H2O 正极反应式为O2 + 2H2O + 4e-=== 4OH- 随着不断放电,电解质溶液碱性不变 甲烷燃料电池的能量利用率比甲烷燃烧的能量利用率大
甲、乙中电解质溶液的pH都增大 理论上甲中每消耗22.4 L CH4(标准状况下), 乙中产生4 mol Cl2 乙中电解MgCl2溶液的总反应为2Cl-+2H2O Cl2↑+H2↑+2OH- 甲中A处通入CH4,电极反应式为CH4+10OH--8e- =
Cl2↑+H2↑+2OH- 甲中A处通入CH4,电极反应式为CH4+10OH--8e- =  +7H2O
+7H2O
负极反应式为CH4 + 10OH--8e-=== CO32-+ 7H2O 正极反应式为O2 + 2H2O + 4e-=== 4OH- 随着不断放电,电解质溶液碱性不变 甲烷燃料电池也可以用稀硫酸做电解质溶液
通甲烷的电极为正极 电池在产生电流过程中,K+向负极移动,OH—向正极移动 正极的电极反应式为:O2+2H2O+4e—=4OH— 通甲烷的电极的电极反应式为:CH4+2O2+4e—= CO2+2H2O
上述燃料电池的负极反应材料是氢气、甲烷、乙醇等物质 氢氧燃料电池常用于航天飞行器,原因之一是该电池的产物为水,经过处理之后可供宇航员使用 乙醇燃料电池的电解质常用KOH,该电池的负极反应为:C2H5OH-12e-==2CO2↑+3H2O 甲烷燃料电池的正极反应为O2+2H2O+4e-== 4OH-
图1中电解质溶液的pH增大 图2中电解AlCl3溶液的总反应为2Cl-+2H2O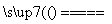 Cl2↑+H2↑+2OH- A.处通入的气体为CH4,电极反应式为CH4+10OH--8e-= CO
Cl2↑+H2↑+2OH- A.处通入的气体为CH4,电极反应式为CH4+10OH--8e-= CO +7H2O 电解池中Cl-向x极移动
+7H2O 电解池中Cl-向x极移动
图2中Y.电极为阴极 图2中总反应的化学方程式为:2AlCl3+6H2O2 2Al(OH)3↓+3Cl2↑+3H2↑ 图1中电解质溶液的pH增大 图1中的a 电极反应式为:CH4-8e-+8OH-=CO2+6H2O
2Al(OH)3↓+3Cl2↑+3H2↑ 图1中电解质溶液的pH增大 图1中的a 电极反应式为:CH4-8e-+8OH-=CO2+6H2O
b电极是正极 a电极的电极反应为: O2 +2 H2O+ 4e- = 4OH- 氢氧燃料电池中的电子是从a电极经外电路流向b电极 氢氧燃料电池是一种不需要将还原剂和氧化剂全部储藏在电池内的新型发电装置 
上述燃料电池的负极反应材料是氢气、甲烷、乙醇等物质 氢氧燃料电池常用于航天飞行器,原因之一是该电池的产物为水,经过处理之后可供宇航员使用 乙醇燃料电池的电解质常用KOH,该电池的负极反应为C2H5OH-12e-=2CO2↑+3H2O 甲烷燃料电池的正极反应为O2+2H2O+4e-=4OH-

 Cl2↑+H2↑+2OH- 甲中A处通入CH4,电极反应式为CH4+10OH--8e- =
Cl2↑+H2↑+2OH- 甲中A处通入CH4,电极反应式为CH4+10OH--8e- =  +7H2O
+7H2O
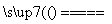 Cl2↑+H2↑+2OH- A.处通入的气体为CH4,电极反应式为CH4+10OH--8e-= CO
Cl2↑+H2↑+2OH- A.处通入的气体为CH4,电极反应式为CH4+10OH--8e-= CO +7H2O 电解池中Cl-向x极移动
+7H2O 电解池中Cl-向x极移动
 2Al(OH)3↓+3Cl2↑+3H2↑ 图1中电解质溶液的pH增大 图1中的a 电极反应式为:CH4-8e-+8OH-=CO2+6H2O
2Al(OH)3↓+3Cl2↑+3H2↑ 图1中电解质溶液的pH增大 图1中的a 电极反应式为:CH4-8e-+8OH-=CO2+6H2O
