你可能感兴趣的试题
摩尔是化学上常用的一个物理量 用托盘天平称取25.20 gNaCl 配制一定物质的量浓度的溶液,定容时俯视刻度线会导致所配溶液浓度偏小 某物质含有6.02×1023个微粒,含有这个数目微粒的物质不一定是1 mol
胶体的丁达尔效应与微粒直径大小有关 氨气的水溶液能够导电,因此NH3是电解质 电解质溶液的导电能力与溶液中离子浓度及离子所带电荷多少有关 向饱和氯化钠溶液中加入一小块钠,溶液中有固体析出
pH=12的Ba(OH)2溶液和pH=12的Na2CO3溶液中,水电离的c(OH-)相等 常温下将醋酸钠、盐酸两溶液混合后,溶液呈中性,则混合后溶液中:c(Na+)>c(Cl-)>c(CH3COOH) 常温下物质的量浓度相等的①NH4HCO3、②NH4HSO4、③NH4Fe(SO4)2:三种溶液中NH4+的浓度:②>③>① 等体积等物质的量浓度的NaClO(aq)与NaCl(aq)中离子总数:N.前>N后
物质的量浓度相等的 和
和 混合溶液中:
混合溶液中:  常温下将醋酸钠、盐酸两溶液混合后,溶液呈中性,则混合后溶液中:
常温下将醋酸钠、盐酸两溶液混合后,溶液呈中性,则混合后溶液中:  常温下
常温下 相等的①
相等的① 、②
、② 、③
、③ 三种溶液中,溶质的物质的量浓度大小:①>②>③ 等体积、等物质的量浓度的
三种溶液中,溶质的物质的量浓度大小:①>②>③ 等体积、等物质的量浓度的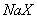 和弱酸
和弱酸 混合后呈酸性的溶液中:
混合后呈酸性的溶液中: 
NaHSO3和NaHCO3的中性混合溶液中(S和C.均用R.表示):c(Na+)=c(HRO3-)+2c(RO32-) 常温下将醋酸钠、盐酸两溶液混合后,溶液呈中性,则混合后溶液中:c(Na+)>c(Cl-)>c(CH3COOH) 常温下物质的量浓度相等的①(NH4)2CO3、②(NH4)2SO4、③NH4HSO4三种溶液中c(NH4+):①<②<③ 相同条件下,pH=5的①NH4Cl溶液、②CH3COOH溶液、③稀盐酸溶液中由水电离出的c(H+):①>②>③
等体积等物质的量浓度的NaClO(aq)与NaCl(aq)中离子总数:N.前>N.后 NaHSO3和NaHCO3的中性混合溶液中(S.和 均用R.表示): c(Na+)>c(HRO3-)+c(RO32-) C.常温下将醋酸钠、盐酸两溶液混合后溶液呈中性,则混合溶液中: c(Na+)>c(Cl-)= c(CH3COOH) 常温下,将0.1mol·L-1NH4Cl溶液与0.05mol·L-1NaOH溶液等体积混合: c(C1-)>c(Na+)>c(NH4+)>c(OH-)>c(H+)
等体积等物质的量浓度NaF 溶液与HF混合:2c(Na+)=c(F)+c(HF) 0.1mol・L-1pH为4的NaHB溶液中:c(HB-)>c(H2B.)>c(B2-) 在NaHA溶液中一定有:c(Na+)+c(H+) =c(HA)+c(OH)+c(A2-) 等物质的量浓度的 (NH4)2SO4 和(NH4)2CO3溶液中的c(NH4+):前者<后者
酸性:HCN>HClO pH:HClO<HCN 浓度:c(CN-)<c(ClO-) 与NaOH恰好完全反应时,消耗NaOH的物质的量:HClO>HCN
pH=4的0.1 mol·L.-1的NaHA溶液中:c(HA-)>c(H+)>c(H2A.)>c(A2-) NaHSO3和NaHCO3两溶液混合呈中性的溶液中(S.和 均用R.表示):c(Na+)=c(HRO3-)+2c(RO32-) C.常温下,等物质的量浓度的三种溶液:①(NH4)2CO3 ②(NH4)2SO4 ③(NH4)2Fe(SO4)2中c(NH4+):①<③<② 常温下,将醋酸钠、盐酸两溶液混合呈中性的溶液中: c(Na+)>c(Cl—)=c(CH3COOH)
等物质的量浓度等体积的NH4HSO4和NaOH溶液混合:c(Na+)=c(SO42-)>c(NH4+)>c(OH-)>c(H+) 常温下,将CH3COONa溶液和稀盐酸混合至溶液pH=7: c(Na+)>c(CH3COOH)=c(Cl-) 物质的量浓度之比为1:2的NaClO、NaHCO3混合溶液中: c(HClO)+c(ClO-)=2c(HCO3-)+2c(H2CO3)+2c(CO32-) pH=1的NaHSO4溶液:c(H+)=2c(SO42-)+c(OH-)
物质的量浓度相等的① NH4HSO4溶液、② NH4HCO3溶液、③ NH4Cl溶液中,pH的大小关系:②>①>③ 90℃时,将CH3COONa溶液和稀盐酸混合至溶液pH=7: c(Na+)>c(CH3COO-)>c(Cl-)=c(CH3COOH)>c(H+)=c(OH-) 将lmolNaClO和2molNaHC03配制成1L混合溶液:c(HClO)+c(ClO-)=2c(HCO3-)+2c(H2CO3)+2c(CO32-) 浓度均为0.1mol/L的NH3·H2O和NH4Cl溶液等体积混合后,若溶液呈碱性,则溶液中: C.(NH4+)>c(Cl-)>c(NH3·H2O)>c(OH-)>c(H+)
pH=2的HA溶液与pH=12的MOH溶液任意比混合: c(H+) + c(M+) === c(OH-) + c(A-) pH相等的CH3COONa、NaOH和Na2CO3三种溶液: c(NaOH)<c(CH3CO ONa)<c(Na2CO3) 物质的量浓度相等CH3COOH和CH3COONa溶液等体积混合: c(CH3COO-) +2c(OH-) === c(H+) + c(CH3COOH) 0.1mol•L-1的NaHA溶液,其pH=4:c(HA-)>c(H+)>c(H2A)>c(A2-)
溶质的物质的量 溶质的质量分数 溶质的质量 溶质的微粒数
常温下将醋酸钠、盐酸两溶液混合后,溶液呈中性,则混合后的溶液中:
c(Na+)>c(Cl-)> c(CH3COOH)
等物质的量浓度等体积的硫化钠溶液与硫酸氢钾溶液混合
C(Na+)> (K+)>C.(SO42-)>C.(HS-)>C.(OH-)>C(H+)
C.用pH=3和pH=2的醋酸溶液中和含等量NaOH的溶液所消耗的醋酸溶液的体积分别为Va和Vb,则Va>10Vb
pH <7的某二元弱酸的酸式盐NaHA溶液中有c(H+)+2 c(A2-)==c(OH-) +c (H2A.)
配制一定物质的量浓度的溶液时,定容时仰视刻度线会导致所配溶液浓度偏高 用托盘天平称取25.20 g NaCl 用100 mL的量筒量取5.2 mL的盐酸 用浓盐酸配制一定物质的量浓度的稀盐酸,量取浓盐酸时仰视量筒的刻度线会导致所配溶液浓度偏高
NaHCO3的溶液中有c (Na+)=c (HCO3-) + c (CO32-) + 2c (H2CO3) 25℃时,pH=2的CH3COOH与pH=12的NaOH等体积混合:c (Na+)> c(CH3COO-) pH=3的盐酸与pH=3的醋酸溶液中,水电离的c(H+)前者小 常温下,物质的量浓度相等的①NH4HCO3 ②(NH4)2CO3 ③NH4HSO4三种溶液中c (NH4+): ②>③>①
NaHSO3和NaHCO3的中性混合溶液中(S.和C.均用R.表示):c(Na+)=c(HRO3-)+2c(RO32-) 常温下将醋酸钠、盐酸两溶液混合后,溶液呈中性,则混合后溶液中:c(Na+)>c(Cl―)>c(CH3COOH) 常温下物质的量浓度相等的①(NH4)2CO3、②(NH4)2SO4、③(NH4)2Fe(SO4)2三种溶液中c(NH4+):①<③<② 等体积等物质的量浓度的NaClO(aq)与NaCl(aq)中离子总数多少:N.前后
NaHSO3和NaHCO3的中性混合溶液中(S.和C.均用R.表示):c(Na+)= c(HRO3-)+2c(RO32﹣) 常温下将物质的量浓度相等的醋酸钠、醋酸两溶液等体积混合,混合后的溶液中,已知c(Na+)>c(CH3COOH),则:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) 常温下,物质的量浓度和体积都相等的①Na2SO3②Na2SO4③NaHSO4三种溶液中离子总数:①<②<③ 常温下,①pH=3的HCl溶液和pH=11的氨水等体积混合液 ②pH=3的HCl溶液 ③pH=11 的氨水中由水电离出的c(H+):①>③>②
常温下将醋酸钠、盐酸两溶液混合后,溶液呈中性,则混合溶液中: c(Na+)>c(Cl―)>c(CH3COOH) 相同条件下,pH=5的①NH4Cl溶液 ②CH3COOH溶液 ③稀盐酸溶液中由水电离的c(H+):①>②>③ PH相等的①NH4Cl;②(NH4)2SO4;③NH4HSO4三种溶液中,c(NH4+)大小顺序①=②>③ 0.1mol/L醋酸钡溶液中,c(Ba2+)>c(CH3COO―)>c(OH―)>c(H+)
常温下将物质的量浓度相等的醋酸钠、醋酸两溶液等体积混合,混合后的溶液中,已知c(Na+)>c(CH3COOH),则:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
NaHSO3和NaHCO3的中性混合溶液中(S.和 均用R.表示):C.(Na+)=c(HRO3-)+2c(RO32-)
C.常温下,物质的量浓度和体积都相等的①Na2SO3②Na2SO4③NaHSO4三种溶液中离子总数:①<②<③
常温下,①pH=3的HCl溶液和pH=11的氨水等体积混合液②pH=3的HCl溶液③pH=11的氨水中由水电离出的c(H.):①>③>②

 和
和 混合溶液中:
混合溶液中:  常温下将醋酸钠、盐酸两溶液混合后,溶液呈中性,则混合后溶液中:
常温下将醋酸钠、盐酸两溶液混合后,溶液呈中性,则混合后溶液中:  常温下
常温下 相等的①
相等的① 、②
、② 、③
、③ 三种溶液中,溶质的物质的量浓度大小:①>②>③ 等体积、等物质的量浓度的
三种溶液中,溶质的物质的量浓度大小:①>②>③ 等体积、等物质的量浓度的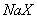 和弱酸
和弱酸 混合后呈酸性的溶液中:
混合后呈酸性的溶液中: 