你可能感兴趣的试题
F +H+I+J E+F+G+H+I+J G+H+I+J D+E+F+G+H+I+J C+D+E+F+G+H+I+J
M>N>H>G H>M>G>N H>M>N>G G>H>M>N
(g)+B(g)→C(g) △H.,分两步进行:①A.(g)+B(g)→X(g)△H1,②X(g) →C(g)△H2, 反应过程中能量变化如图所示,E1表示A.+B→X的活化能,下列说法正确的是( ) 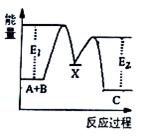 A. △H1=△H.一△H2>0 X.是反应A.(g)+B(g)→C(g)的催化剂 E2是反应②的活化能 △H1=E1-E2
A. △H1=△H.一△H2>0 X.是反应A.(g)+B(g)→C(g)的催化剂 E2是反应②的活化能 △H1=E1-E2
CO+H2O===CO2+H2ΔH.=+41 kJ·mol-1  CO(g)+H2O(g)===CO2(g)+H2(g) ΔH.=-41 kJ·mol-1 CO2(g)+H2(g)===CO(g)+H2O(g) ΔH.=+41 kJ·mol-1 CO2(g)+H2(g)===CO(g)+H2O(g) ΔH.=-41 kJ·mol-1
CO(g)+H2O(g)===CO2(g)+H2(g) ΔH.=-41 kJ·mol-1 CO2(g)+H2(g)===CO(g)+H2O(g) ΔH.=+41 kJ·mol-1 CO2(g)+H2(g)===CO(g)+H2O(g) ΔH.=-41 kJ·mol-1
H2O(g)═H2O(l)△H=﹣44kJ/mol 2HI(g)═H2(g)+I2(g)△H=+14.9kJ/mol 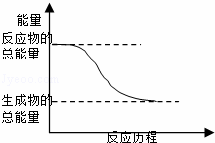 能量变化如图所示的化学反应 形成化学键时放出能量的化学反应
能量变化如图所示的化学反应 形成化学键时放出能量的化学反应
能量变化如图所示的化学反应 H2O(g)=H2O(l);△H.=-44.0 kJ/mol 形成化学键时共放出能量862 kJ的化学反应 2HI(g)=H2(g)+I2(g);△H.=+14.9 kJ/mol
H2O(g)=H2O(l);△H.=-44.0 kJ/mol 形成化学键时共放出能量862 kJ的化学反应 2HI(g)=H2(g)+I2(g);△H.=+14.9 kJ/mol
△H<0、△S>0 △H>0、△S<0 △H>0、△S>0 △H<0、△S<0
△H<0、△S>0 △H>0、△S<0 △H>0、△S>0 △H<0、△S<0
G+H+I+J F+H+I+J E+F+G+H+I+J D+E+F+G+H+I+J C+D+E+F+G+H+I+J
H2(g)+ O2(g)===H2O(g) ΔH.=(a+b) kJ/mol 2H2(g)+O2(g)===2H2O(g) ΔH.=2(b-a) kJ/mol H2(g)+
O2(g)===H2O(g) ΔH.=(a+b) kJ/mol 2H2(g)+O2(g)===2H2O(g) ΔH.=2(b-a) kJ/mol H2(g)+ O2(g)===H2O(l) ΔH.=(b+c-a) kJ/mol 2H2(g)+O2(g)===2H2O(l) ΔH.=2(a-b-c) kJ/mol
O2(g)===H2O(l) ΔH.=(b+c-a) kJ/mol 2H2(g)+O2(g)===2H2O(l) ΔH.=2(a-b-c) kJ/mol
E.,F.,G. F.,G.,H. G.,H. ,E. H.,E.,F.
(g)+ (g)―→C(g) ΔH,分两步进行:①A(g)+B.(g)―→X(g) ΔH1; ②X(g)―→C(g) ΔH2。反应过程中能量变化如图1所示, E1表示A.+B―→X的活化能,下列说法正确的是 A.ΔH1=ΔH-ΔH2>0 B.X.是反应A.(g)+B.(g)―→C(g)的催化剂 E2是反应②的活化能 ΔH=E1-E2
CO+H2O===CO2+H2ΔH.=+41 kJ·mol-1  CO(g)+H2O(g)===CO2(g)+H2(g) ΔH.=-41 kJ·mol-1 CO2(g)+H2(g)===CO(g)+H2O(g) ΔH.=+41 kJ·mol-1 CO2(g)+H2(g)===CO(g)+H2O(g) ΔH.=-41 kJ·mol-1
CO(g)+H2O(g)===CO2(g)+H2(g) ΔH.=-41 kJ·mol-1 CO2(g)+H2(g)===CO(g)+H2O(g) ΔH.=+41 kJ·mol-1 CO2(g)+H2(g)===CO(g)+H2O(g) ΔH.=-41 kJ·mol-1
H2O(g)===H2O(l)ΔH.=-44.0 kJ/mol 2HI(g)===H2(g)+I2(g) ΔH.=+14.9 kJ/mol 形成化学键时共放出能量862 kJ的化学反应 能量变化如图所示的化学反应 
该反应为吸热反应 1mol CO2(g)和1mol H2(g)反应生成1molCO(g)和1mol H2O(g)要放出41kJ热量 反应的热化学方程式是:CO(g) + H2O (g) = CO2(g) + H2(g) △H=+41kJ/mol CO(g)与H2O(g)所具有的总能量大于CO2(g)与H2(g)所具有的总能量
由①、②知,2H2S(g)+O2(g)===2S(g)+2H2O(g) ΔH.=-443.4kJ/mol 由①知,氢气的燃烧热为241.8kJ 反应②中的能量变化可用如图表示 若反应②中改用固态硫,则放热大于20.1kJ
(g)+B(g)=C(g)△H,分两步进行:  ①A(g)+B(g)=X(g)△H1 ②X(g)=C(g)△H2 反应过程中能量变化如图所示,E1表示A.+B=X的活化能,下列说法正确的是( ) A.△H=E1-E2 X.是反应A.(g)+B(g)= (g)的催化剂 C.E2是反应②的活化能 △Hl=△H-△H2>0
①A(g)+B(g)=X(g)△H1 ②X(g)=C(g)△H2 反应过程中能量变化如图所示,E1表示A.+B=X的活化能,下列说法正确的是( ) A.△H=E1-E2 X.是反应A.(g)+B(g)= (g)的催化剂 C.E2是反应②的活化能 △Hl=△H-△H2>0
N2(g)+3H2(g)⇌2NH3(l)△H=2(a﹣b﹣c)kJ/mol N2(g)+3H2(g)⇌2NH3(g)△H=2(b﹣a)kJ/mol 0.5N2(g)+1.5H2(g)⇌NH3(l)△H=(b+c﹣a)kJ/mol 0.5N2(g)+1.5H2(g)⇌NH3(g)△H=(a+b)kJ/mol 
该反应为吸热反应 CO(g)和H2O(g)所具有的总能量大于CO2(g)和H2(g)所具有的总能量 反应的热化学方程式:CO(g)+H2O(g)===CO2(g)+H2(g) ΔH.=41 kJ·mol-1 1 mol CO2(g)和1 mol H2(g)反应生成1 mol CO(g)和H2O(g)要放出41 kJ的热量

 A. △H1=△H.一△H2>0 X.是反应A.(g)+B(g)→C(g)的催化剂 E2是反应②的活化能 △H1=E1-E2
A. △H1=△H.一△H2>0 X.是反应A.(g)+B(g)→C(g)的催化剂 E2是反应②的活化能 △H1=E1-E2
 CO(g)+H2O(g)===CO2(g)+H2(g) ΔH.=-41 kJ·mol-1 CO2(g)+H2(g)===CO(g)+H2O(g) ΔH.=+41 kJ·mol-1 CO2(g)+H2(g)===CO(g)+H2O(g) ΔH.=-41 kJ·mol-1
CO(g)+H2O(g)===CO2(g)+H2(g) ΔH.=-41 kJ·mol-1 CO2(g)+H2(g)===CO(g)+H2O(g) ΔH.=+41 kJ·mol-1 CO2(g)+H2(g)===CO(g)+H2O(g) ΔH.=-41 kJ·mol-1
 能量变化如图所示的化学反应 形成化学键时放出能量的化学反应
能量变化如图所示的化学反应 形成化学键时放出能量的化学反应
 H2O(g)=H2O(l);△H.=-44.0 kJ/mol 形成化学键时共放出能量862 kJ的化学反应 2HI(g)=H2(g)+I2(g);△H.=+14.9 kJ/mol
H2O(g)=H2O(l);△H.=-44.0 kJ/mol 形成化学键时共放出能量862 kJ的化学反应 2HI(g)=H2(g)+I2(g);△H.=+14.9 kJ/mol
 O2(g)===H2O(g) ΔH.=(a+b) kJ/mol 2H2(g)+O2(g)===2H2O(g) ΔH.=2(b-a) kJ/mol H2(g)+
O2(g)===H2O(g) ΔH.=(a+b) kJ/mol 2H2(g)+O2(g)===2H2O(g) ΔH.=2(b-a) kJ/mol H2(g)+ O2(g)===H2O(l) ΔH.=(b+c-a) kJ/mol 2H2(g)+O2(g)===2H2O(l) ΔH.=2(a-b-c) kJ/mol
O2(g)===H2O(l) ΔH.=(b+c-a) kJ/mol 2H2(g)+O2(g)===2H2O(l) ΔH.=2(a-b-c) kJ/mol
 CO(g)+H2O(g)===CO2(g)+H2(g) ΔH.=-41 kJ·mol-1 CO2(g)+H2(g)===CO(g)+H2O(g) ΔH.=+41 kJ·mol-1 CO2(g)+H2(g)===CO(g)+H2O(g) ΔH.=-41 kJ·mol-1
CO(g)+H2O(g)===CO2(g)+H2(g) ΔH.=-41 kJ·mol-1 CO2(g)+H2(g)===CO(g)+H2O(g) ΔH.=+41 kJ·mol-1 CO2(g)+H2(g)===CO(g)+H2O(g) ΔH.=-41 kJ·mol-1

 ①A(g)+B(g)=X(g)△H1 ②X(g)=C(g)△H2 反应过程中能量变化如图所示,E1表示A.+B=X的活化能,下列说法正确的是( ) A.△H=E1-E2 X.是反应A.(g)+B(g)= (g)的催化剂 C.E2是反应②的活化能 △Hl=△H-△H2>0
①A(g)+B(g)=X(g)△H1 ②X(g)=C(g)△H2 反应过程中能量变化如图所示,E1表示A.+B=X的活化能,下列说法正确的是( ) A.△H=E1-E2 X.是反应A.(g)+B(g)= (g)的催化剂 C.E2是反应②的活化能 △Hl=△H-△H2>0
