你可能感兴趣的试题
原电池工作时H+在铜电极被氧化成H2 原电池工作时Zn发生氧化反应 原电池工作时SO42-移向铜极 原电池工作时电子通过电解质由Zn流向Cu
铜棒逐渐溶解 该装置能将电能转化为化学能 电子由铁棒通过导线流向铜棒 正极反应为Fe-2e-=Fe2+ 
锌片逐渐溶解 烧杯中溶液逐渐呈蓝色 电子由铜片通过导线流向锌片 该装置能将电能转变为化学能 
锌片为负极,且逐渐溶解 铜片为正极,铜不易失电子而受到保护 电子由锌片通过导线流向铜片,H+往铜片运动 该装置能将电能转变为化学能
电子由铜极流向锌极 铜极质量增加 锌极上有气泡产生 锌极上发生氧化反应
锌片为负极,且锌片逐渐溶解 铜为正极,铜不易失电子而受到保护 电子由铜片通过导线流向锌片 该装置能将化学能转变为电能 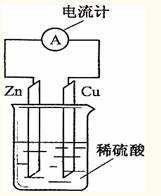
电子由铜片通过导线流向锌片 锌得电子,被还原 锌为负极,铜为正极 该装置能将电能转变为化学能
锌片是正极 铜片是负极 电子由锌片通过导线流向铜片 该装置能够将电能转化为化学能
铜电极是负极 锌电极是正极 铜电极上发生氧化反应 锌电极上发生氧化反应
锌片逐渐溶解 烧杯中溶液逐渐呈蓝色 电流由锌片通过导线流向铜片 该装置能将电能转变为化学能
锌片为负极,且锌片逐渐溶解 铜片为正极,且铜片上有气泡 电子由铜片通过导线流向锌片 该装置能将化学能转变为电能 
该原电池中,铜为正极 该原电池中,电子由铜片经过导线流入锌片 该原电池工作一段时间后,溶液的酸性减弱 该原电池工作一段时间后,锌片质量减小
Cu电极为正极 原电池工作时,电子从Zn电极流出 原电池工作时的总反应为:Zn+Cu2+=Zn2++Cu 盐桥(琼脂-饱和KCl溶液)中的K.+移向ZnSO4溶液
锌片逐渐溶解 烧杯中溶液逐渐呈蓝色 电子由铜片通过导线流向锌片 该装置能将电能转变为化学能
一段时间后,铜片质量会变小 电流由锌片通过导线流向铜片 将稀硫酸换成乙醇,灯泡亮度不变 电流计指针发生偏转
溶液逐渐变蓝 锌片逐渐溶解 铜片上有气泡产生 电流计指针发生偏转
锌作正极 溶液中SO42-向铜电极方向移动 电子由锌片通过导线流向铜 负极发生的反应是:2H+ +2e-=H2↑ 
锌片为负极,且锌片逐渐溶解 铜片为正极,且铜片上有气泡 电子由铜片通过导线流向锌片 该装置能将化学能转变为电能 
负极发生氧化反应 烧杯中的溶液变为蓝色 电子由铜片通过导线流向锌片 该装置能将电能转变为化学能






