你可能感兴趣的试题
甲烷的燃烧热△H=-890.3kJ/mol,则甲烷燃烧的热化学方程式可表示为: CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-890.3 kJ·mol-1 一定条件下,将0.5molN2和1.5molH2置于密闭容器中充分反应生成NH3放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)  2NH3(g) ΔH=-38.6kJ/mol 在l0lkPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)=2H2O⑴ △H=-571.6kJ/mol HCl和NaOH反应的中和热△H=-57.3kJ/mol,则H2SO4和Ba(OH)2反应的中和热△H =2×(- 57.3) kJ/mol
2NH3(g) ΔH=-38.6kJ/mol 在l0lkPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)=2H2O⑴ △H=-571.6kJ/mol HCl和NaOH反应的中和热△H=-57.3kJ/mol,则H2SO4和Ba(OH)2反应的中和热△H =2×(- 57.3) kJ/mol
甲烷的燃烧热△H=﹣890.3kJ/mol,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=﹣890.3 kJ/mol 一定条件下,将0.5 mol N2和1.5 molH2置于密闭容器中充分反应生成NH3放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)⇌2NH3(g)△H=﹣38.6 kJ/mol 在101kPa时,2gH2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)═2H2O(l)△H=﹣571.6 kJ/mol HCl和NaOH反应的中和热△H=﹣57.3 kJ/mol,则H2SO4和Ba(OH)2反应的中和热△H=2×(﹣57.3)kJ/mol
甲烷加氧气在点燃条件下,反应生成二氧化碳和水 1个甲烷和2个氧气在点燃条件下,生成1个二氧化碳和2个水 1个CH4分子和2个O2分子在点燃条件下,生成1个CO2分子和2个H2O分子 1 gCH4和2 gO2在点燃条件下,生成1 gCO2和2 gH2O
甲烷的燃烧热为890.3 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH=-890.3 kJ·mol-1 500 ℃、30 MPa下,将0.5 mol N2和1.5 mol H2置于密闭容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为N2(g)+3H2(g) 2NH3(g) ΔH=-38.6 kJ·mol-1 已知在120 ℃、101 kPa下,1 g H2燃烧生成水蒸气放出121 kJ热量,其热化学方程式为H2(g)+1/2O2(g)===H2O(g) ΔH=-242 kJ·mol-1 25 ℃、101 kPa时,强酸与强碱的稀溶液发生反应的中和热为57.3 kJ·mol-1,硫酸稀溶液与氢氧化钾稀溶液反应的热化学方程式为:H2SO4(aq)+2KOH(aq)= K2SO4(aq)+2H2O(l) ΔH=-114.6 kJ·mol-1
2NH3(g) ΔH=-38.6 kJ·mol-1 已知在120 ℃、101 kPa下,1 g H2燃烧生成水蒸气放出121 kJ热量,其热化学方程式为H2(g)+1/2O2(g)===H2O(g) ΔH=-242 kJ·mol-1 25 ℃、101 kPa时,强酸与强碱的稀溶液发生反应的中和热为57.3 kJ·mol-1,硫酸稀溶液与氢氧化钾稀溶液反应的热化学方程式为:H2SO4(aq)+2KOH(aq)= K2SO4(aq)+2H2O(l) ΔH=-114.6 kJ·mol-1
1/2CH4(g) + O2(g) = 1/2CO2(g) + H2O(l) ΔH.= +445 kJ·mol-1 CH4(g) + 2O2(g) = CO2(g) +2H2O(l) ΔH.= +890 kJ·mol-1 CH4(g) + 2O2(g) = CO2(g) +2H2O(l) ΔH.= -890 kJ·mol-1 2CH4(g) + 4O2(g) = 2CO2(g) + 4H2O(l) ΔH.= -1780 kJ·mol-1
CH4+2O2→CO2+2H2O+311.4kJ CH4(g)+2O2(g)→CO2(g)+2H2O(l)+311.4kJ CH4(g)+2O2(g)→CO2(g)+2H2O(l)+889.7kJ CH4(g)+2O2(g)→CO2(g)+2H2O(g)+889.7kJ
甲烷的标准燃烧热为-890.3kJ·mol-1,则甲烷燃烧的热化学方程式可表示为: CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-890.3kJ·mol-1 Na2CO3溶液呈碱性: CO32- + 2H2O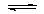 H2CO3+2OH- 氯化镁溶液与氨水反应:Mg2+ +2NH3•H2O==2NH4+ +Mg(OH)2↓ 氯气溶于水制备次氯酸:Cl2+H2O==2H+ +Cl-+ +ClO-
H2CO3+2OH- 氯化镁溶液与氨水反应:Mg2+ +2NH3•H2O==2NH4+ +Mg(OH)2↓ 氯气溶于水制备次氯酸:Cl2+H2O==2H+ +Cl-+ +ClO-
甲烷的燃烧热为-890 kJ/mol,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+ 2H2O(g)△H=-890 kJ/mol
在一定条件下将1 molSO2和0.5molO2置于密闭容器中充分反应,放出热量79.2kJ,则反应的热化学方程式为:2SO2(g)+O2(g) 2SO3(g) △H=-158.4kJ·mol-1 NaOH(s)+1/2H2SO4(浓)=1/2Na2SO4(aq)+H2O(l) △H=-57.3kJ·mol-1 2.00gC2H2气体完全燃烧生成液态水和二氧化碳气体放出99.6kJ的热量,该反应的热化学方程式为:2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) △H=-2589.6kJ·mol-1
2SO3(g) △H=-158.4kJ·mol-1 NaOH(s)+1/2H2SO4(浓)=1/2Na2SO4(aq)+H2O(l) △H=-57.3kJ·mol-1 2.00gC2H2气体完全燃烧生成液态水和二氧化碳气体放出99.6kJ的热量,该反应的热化学方程式为:2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) △H=-2589.6kJ·mol-1
2CH4+O2=2CO2+H2O CH4+O2=CO2+2H2O CH4+2O2=CO2+2H2O 
1/2CH4(g) + O2(g) = 1/2CO2(g) + H2O(l) ΔH.= +445 kJ·mol-1 CH4(g) + 2O2(g) = CO2(g) +2H2O(l) ΔH.= +890 kJ·mol-1 CH4(g) + 2O2(g) = CO2(g) +2H2O(l) ΔH.= -890 kJ·mol-1 2CH4(g) + 4O2(g) = 2CO2(g) + 4H2O(l) ΔH.= -1780 kJ·mol-1
甲烷的燃烧热为890.3 kJ·mol-1,则甲烷燃烧热的热化学方程式可表示为:CH4(g)+2O2(g)==CO2(g)+2H2O(g) ΔH.=-890.3 kJ·mol-1 已知1 g液态肼和足量液态过氧化氢反应生成氮气和水蒸气时放出20.05 kJ的热量,肼和过氧化氢反应的热化学方程式为:N2H4(l)+2H2O2(l)===N2(g)+4H2O(g) ΔH.=-641.6 kJ·mol-1 500 ℃、30 MPa 下,将0.1 mol N2 和 0.3 mol H2 置于密闭容器中充分反应生成NH3(g),放热3.86 kJ,其热化学方程式为:N2(g)+3H2(g) 2NH3(g) ΔH.=-38.6 kJ·mol-1 CO的燃烧热是283.0kJ/mol,则2CO2(g)=2CO(g)+O2(g) △H=+283.0kJ/mol
2NH3(g) ΔH.=-38.6 kJ·mol-1 CO的燃烧热是283.0kJ/mol,则2CO2(g)=2CO(g)+O2(g) △H=+283.0kJ/mol
NH3·H2O的电离方程式:NH3·H2O=NH4++OH- 铁发生吸氧腐蚀的正极反应:O2+2H2O+4e-=4OH- 碳酸钠水解的离子方程式:CO32-+2H2O=2OH—+H2CO3 甲烷的燃烧热是890kJ/mol,则甲烷燃烧的热化学方程式: CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H.=+890kJ/mol
1/2CH4(g)+ O2(g)=1/2CO2(g)+ H2O(l) △H =+445kJ·mol-1 CH4(g)+ 2O2(g)= CO2(g)+2H2O(l) △H =+890kJ·mol-1 CH4(g)+ 2O2(g)= CO2(g) +2H2O(l) △H =-890kJ·mol-1 2CH4(g) + 4O2(g)= 2CO2(g)+ 4H2O(l) △H =-1780kJ·mol-1
氢气的燃烧热为285.5 kJ/mol,则水电解的热化学方程式为: 2H2O(l)=2H2(g)+O2(g) △H=+285.5kJ/mol 1mol甲烷完全燃烧生成CO2和H2O(l)时放出890 kJ热量,它的热化学方程式为:1/2CH4(g)+O2(g)=1/2CO2(g)+H2O(l) △H=-445kJ/mol 已知2C(s)+O2(g)=2CO(g) △H= -221 kJ/mol,则C.(碳)的燃烧热为110.5 kJ/mol 醋酸与NaOH溶液反应:H+(aq)+OH-(aq)=H2O(l) △H=-57.3 kJ/mol

 2NH3(g) ΔH=-38.6kJ/mol 在l0lkPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)=2H2O⑴ △H=-571.6kJ/mol HCl和NaOH反应的中和热△H=-57.3kJ/mol,则H2SO4和Ba(OH)2反应的中和热△H =2×(- 57.3) kJ/mol
2NH3(g) ΔH=-38.6kJ/mol 在l0lkPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)=2H2O⑴ △H=-571.6kJ/mol HCl和NaOH反应的中和热△H=-57.3kJ/mol,则H2SO4和Ba(OH)2反应的中和热△H =2×(- 57.3) kJ/mol
 2NH3(g) ΔH=-38.6 kJ·mol-1 已知在120 ℃、101 kPa下,1 g H2燃烧生成水蒸气放出121 kJ热量,其热化学方程式为H2(g)+1/2O2(g)===H2O(g) ΔH=-242 kJ·mol-1 25 ℃、101 kPa时,强酸与强碱的稀溶液发生反应的中和热为57.3 kJ·mol-1,硫酸稀溶液与氢氧化钾稀溶液反应的热化学方程式为:H2SO4(aq)+2KOH(aq)= K2SO4(aq)+2H2O(l) ΔH=-114.6 kJ·mol-1
2NH3(g) ΔH=-38.6 kJ·mol-1 已知在120 ℃、101 kPa下,1 g H2燃烧生成水蒸气放出121 kJ热量,其热化学方程式为H2(g)+1/2O2(g)===H2O(g) ΔH=-242 kJ·mol-1 25 ℃、101 kPa时,强酸与强碱的稀溶液发生反应的中和热为57.3 kJ·mol-1,硫酸稀溶液与氢氧化钾稀溶液反应的热化学方程式为:H2SO4(aq)+2KOH(aq)= K2SO4(aq)+2H2O(l) ΔH=-114.6 kJ·mol-1
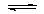 H2CO3+2OH- 氯化镁溶液与氨水反应:Mg2+ +2NH3•H2O==2NH4+ +Mg(OH)2↓ 氯气溶于水制备次氯酸:Cl2+H2O==2H+ +Cl-+ +ClO-
H2CO3+2OH- 氯化镁溶液与氨水反应:Mg2+ +2NH3•H2O==2NH4+ +Mg(OH)2↓ 氯气溶于水制备次氯酸:Cl2+H2O==2H+ +Cl-+ +ClO-
 2SO3(g) △H=-158.4kJ·mol-1 NaOH(s)+1/2H2SO4(浓)=1/2Na2SO4(aq)+H2O(l) △H=-57.3kJ·mol-1 2.00gC2H2气体完全燃烧生成液态水和二氧化碳气体放出99.6kJ的热量,该反应的热化学方程式为:2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) △H=-2589.6kJ·mol-1
2SO3(g) △H=-158.4kJ·mol-1 NaOH(s)+1/2H2SO4(浓)=1/2Na2SO4(aq)+H2O(l) △H=-57.3kJ·mol-1 2.00gC2H2气体完全燃烧生成液态水和二氧化碳气体放出99.6kJ的热量,该反应的热化学方程式为:2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) △H=-2589.6kJ·mol-1

 2NH3(g) ΔH.=-38.6 kJ·mol-1 CO的燃烧热是283.0kJ/mol,则2CO2(g)=2CO(g)+O2(g) △H=+283.0kJ/mol
2NH3(g) ΔH.=-38.6 kJ·mol-1 CO的燃烧热是283.0kJ/mol,则2CO2(g)=2CO(g)+O2(g) △H=+283.0kJ/mol