你可能感兴趣的试题
常温下将pH=2的醋酸和pH=12的NaOH溶液等体积混合,所得溶液显碱性 已知同温时氢氟酸的电离常数大于亚硝酸的电离常数,则相同温度相同浓度的NaF溶液和NaNO2溶液的碱性:NaF溶液较强 将等体积的盐酸和氨水混合,充分反应后所得溶液呈中性,则两溶液的物质的量浓度关系为:c(HCl)<c(NH3·H2O) 常温下,pH均为5的醋酸和硫酸铝溶液,由水电离出的氢离子浓度均为1×10-9 mol·L-1
0.25%NaF溶液 0.05%NaF溶液 0.2%NaF溶液 5%NaF溶液 2%NaF溶液
0.02%NaF溶液 0.05%NaF溶液 0.2%NaF溶液 0.5%NaF溶液 2%NaF溶液
n12,n3>n4 n12,n34 n1>n2,n34 n1>n2,n3>n4
将pH=2的盐酸和pH=4的硫酸等体积混合,所得溶液pH=3
HF比HCN易电离,则NaF溶液的pH比同浓度NaCN溶液的pH大 向0.1 mol/L氨水中加入少量硫酸铵固体,溶液中 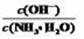 增大 将1 mL pH=3的HA溶液稀释到10 mL,若溶液的pH<4,则HA为弱酸
增大 将1 mL pH=3的HA溶液稀释到10 mL,若溶液的pH<4,则HA为弱酸
0.02%NaF溶液 0.05%NaF溶液 0.2%NaF溶液 0.5%NaF溶液 2%NaF溶液
0.25%NaF溶液 0.05%NaF溶液 0.2%NaF溶液 5%NaF溶液 2%NaF溶液
pH=3的HF溶液和pH=11的NaF溶液中, 由水电离出 的c(H+)相等 在①点时pH=6,溶液中:c(F-)-c(Na+) = 9.9×10-7mol/L 在②点时,溶液中:c(F-) < c(Na+) 在③点时V.=20mL,溶液中:c(F—) < c(Na+)=0.1mol/L
浓度均为0.1 mol·L-1的NaF、CH3COONa溶液相比较,CH3COONa溶液碱性较强 0.1 mol·L-1 CH3COOH溶液,加水稀释过程中,所有离子浓度均减小 NaF溶液中只含有Na+、F.-、H.+、OH-、H2O五种微粒 NaF溶液中加入少量NaOH固体,溶液中c(F-)变小
0.2% NaF,8%~10% SnF2或APF 2% NaF,8%~10% SnF2或APF 2% NaF,2%~5% SnF2或APF 2% NaF,2%~8% SnF2及APF 2% NaF,10%~15% SnF2及APF
0.02%NaF溶液 0.05%NaF溶液 0.2%NaF溶液 0.5%NaF溶液 2%NaF溶液
NaF=NaCl NaF>NaCl NaF<NaCl 无法确定
0.2%NaF,8%~10%SnF2或APF 2%NaF,8%~10%SnF2或APF 2%NaF,2%~5%SnF2或APF 2%NaF,2%~8%SnF2及APF 2%NaF,10%~15%SnF2及APF
0.2%NaF,8%~10%SnF2或APF 2%NaF,8%~10%SnF2或APF 2%NaF,2%~5%SnF2或APF 2%NaF,2%~8%SnF2及APF 2%NaF,10%~15%SnF2及APF

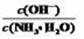 增大 将1 mL pH=3的HA溶液稀释到10 mL,若溶液的pH<4,则HA为弱酸
增大 将1 mL pH=3的HA溶液稀释到10 mL,若溶液的pH<4,则HA为弱酸