你可能感兴趣的试题
正极反应式: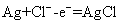 每生成1 mol
每生成1 mol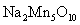 转移2 mol电子
转移2 mol电子  不断向“水”电池的负极移动
不断向“水”电池的负极移动  是还原产物
是还原产物
Li是负极,电极反应为Li+e-=Li+ Li是正极,电极反应为Li+e-=Li- MnO2是负极,电极反应为MnO2+e-=MnO2- 锂电池是一种环保型电池
正极反应式:Ag+Cl--e-=AgCl 每生成1 mol Na2Mn5O10转移2 mol电子 Na+不断向“水”电池的负极移动 AgCl是还原产物
正极反应式Ag+Cl—-e—═AgCl AgCl是还原产物 Na+不断向“水”电池的负极移动 每生成1 molNa2Mn5O10转移2 mol电子
正极反应式:Ag+(Cl^-)-(e^-)=AgCl 没生成1molNa2Mn5O10转移2mol电子 Na^+不断向水电池的负极移动 AgCl是还原产物
正极反应式:Ag+Cl--e-=AgCl 每生成1mol Na2Mn5O10转移2mol电子 Na+不断向“水”电池的负极移动 AgCl是还原产物
负极反应式:Ag+Cl-+e-===AgCl 电池的正极用二氧化锰纳米棒为材料,可大大提高发电效率 Na+不断向“水”电池的负极移动 每转移2 mol电子,正极就有5 mol MnO2被氧化
水既是氧化剂又是溶剂 放电时正极上有氢气生成 放电时OH-向正极移动 总反应为2Li+2H2O===2LiOH+H2↑
正极反应式:Ag+Cl--e-=AgCl 每生成1 mol Na2Mn5O10转移2 mol电子 Na+不断向“水”电池的负极移动 AgCl是还原产物
正极反应式:Ag+Cl--e-=AgCl 每生成1 mol Na2Mn5O10转移2 mol电子 Na+不断向“水”电池的负极移动 AgCl是还原产物
正极反应式:Ag+Cl﹣﹣e﹣=AgCl 每生成1mol Na2Mn5O.10转移2mol电子 Na+不断向“水”电池的负极移动 AgCl是还原产物
正极反应式:Ag+Cl--e-===AgCl Na+不断向“水”电池的负极移动 每生成1 mol Na2Mn5O10转移2 mol电子 AgCl是还原产物
正极反应式:Ag+Cl− − e- AgCl AgCl是还原产物 Na+不断向“水”电池的负极移动 每生成1 mol Na2Mn5O10转移2 mol电子
正极反应式为:5MnO2+2e-= Mn5O102- 每生成1mol AgCl转移2mol电子 Cl-不断向“水电池”的正极移动 Ag发生还原反应
正极反应式:Ag+Cl–-e–=AgCl AgCl是还原产物 Na+不断向“水”电池的负极移动 每生成1 mol Na2Mn5O10转移2 mol电子
正极反应式:Ag-e-+Cl-=AgCl↓ AgCl是还原产物 Na+不断向“水”电池的负极移动 每生成1 mol Na2Mn5O10转移2 mol电子
正极反应式:Ag+Cl--e-===AgCl 每生成1 mol Na2Mn5O10转移2 mol电子 Na+不断向“水”电池的负极移动 AgCl是还原产物
I.为负极,其电极反应式为Ag + Cl―+ e― == AgCl “水”电池内Na+不断向负极作定向移动 每转移1 mol e―,U.型管中消耗0.5 mol H2O “水”电池内,每生成1 mol Na2Mn5O10,X.电极上生成1 mol气体
正极反应式:Ag+Cl--e-=AgCl 每生成1 molNa2Mn5O10转移2 mol电子
Na+不断向“水”电池的负极移动 AgCl是还原产物

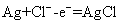 每生成1 mol
每生成1 mol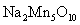 转移2 mol电子
转移2 mol电子  不断向“水”电池的负极移动
不断向“水”电池的负极移动  是还原产物
是还原产物