你可能感兴趣的试题
Ka2(H2X)的数量级为10–4 NaHX溶液中c(H+)>c(OH-) 曲线N.表示pH与1g[c(X2-)/c(HX-)]的变化关系 当混合溶液呈中性时,c(Na+) >c(HX-) > c(X2-) > c(OH-) =c(H+)
K.a(H2X)的数量级为10-6 曲线N.表示pH与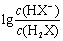 的变化关系 NaHX溶液中c(H+)>C.(OH-) 当混合溶液呈中性时,c(Na+)>C.(HX-)>C.(X-)>c(H+)=C(OH-)
的变化关系 NaHX溶液中c(H+)>C.(OH-) 当混合溶液呈中性时,c(Na+)>C.(HX-)>C.(X-)>c(H+)=C(OH-)
①溶液中:c(A-)>c(Na+)>c(OH-)>c(H+) ①溶液中:c(HA)+c(A-)=0.1mol/L 常温下,0.1mol/LHA溶液的pH=1 0.1mol/LHA溶液中:c(HA)>c(A-)
常温下,测得醋酸钠溶液的pH>7 常温下,测得0.1mol/L醋酸溶液的pH=4 常温下,将pH=1的醋酸溶液稀释1000倍,测得pH<4 常温下,将物质的量浓度相同的醋酸溶液与氢氧化钠溶液等体积混合后恰好中和
某醋酸溶液的pH=a,将此溶液稀释1倍后,溶液的pH=b,则a﹥b 在滴有酚酞的氨水里,加入NH4Cl至溶液恰好无色,则此时溶液的pH<7 常温下,1.0×10-3 mol·L-1盐酸的pH=3.0,1.0×10-8 mol·L-1盐酸的pH=8.0 常温下,若1 mL pH=1的盐酸与100 mLNaOH溶液混合后,溶液的pH=7,则NaOH溶液的pH=11
Ka2(H2X)的数量级为10–4 NaHX溶液中c(H+)>c(OH-) 曲线N.表示pH与1g[c(X2-)/c(HX-)]的变化关系 当混合溶液呈中性时,c(Na+) >c(HX-) > c(X2-) > c(OH-) =c(H+)
从甲组情况分析,若a=7,则HX为强酸;若a>7,则HX为弱酸 在乙组混合溶液中,离子浓度c(X-)=c(Na+) 从丙组实验结果分析,HX是弱酸 丁组实验所得混合溶液中,由水电离出的c(OH-)=10-10 mol/L
Ka2(H2X)的数量级为10–4 NaHX溶液中c(H+)>c(OH-) 曲线N.表示pH与1g[c(X2-)/c(HX-)]的变化关系 当混合溶液呈中性时,c(Na+) >c(HX-) > c(X2-) > c(OH-) =c(H+)
Ka(HX)数量级为10﹣5 曲线N表示pH与的lg 变化关系 升高溶液温度,可使溶液由a点变到b点 向HX.HY的混合溶液中滴加NaOH溶液至中性时,溶液中c(Na+)=c(X﹣)+c(Y﹣)
变化关系 升高溶液温度,可使溶液由a点变到b点 向HX.HY的混合溶液中滴加NaOH溶液至中性时,溶液中c(Na+)=c(X﹣)+c(Y﹣)
常温下,pH相同的NaOH溶液和Ba(OH)2溶液中,水的电离程度相同 常温下,将pH=3的硫酸和pH=11的氨水等体积混合后,所得溶液的pH>7 常温下,将醋酸溶液与NaOH 溶液等体积混合后,若所得溶液的pH=7,则原溶液中c(CH3COOH)>c(NaOH) 常温下,pH=1的NaHSO4溶液:c(H+)=2c(SO42-)+c(OH-)
)t℃时,某溶液的pH=6,则该溶液一定为酸性 ( )常温下,将pH=11的氨水稀释后,溶液中所有离子的浓度均降低 ( )常温下,将pH=11的NaOH溶液和pH=3的CH3COOH溶液等体积混合后,溶液的pH<7 ( )常温下,物质的量浓度和体积相同的K2CO3、K2SO4、HC1溶液混合后,溶液的 pH<7
常温下,将pH=3的盐酸与pH=b的氨水等体积混合,混合液pH=7,则b<11 pH=11的Na2CO3溶液加水稀释,溶液中所有的离子浓度均降低 常温下醋酸分子不可能存在于pH>7的碱性溶液中 0.1mol/L酸HA与0.1mol/L NaOH溶液等体积混合后pH>7,则c(Na+)=c(A.-)+c(HA)=0.1mol/L
t℃时,某溶液的pH=6,则该溶液一定为酸性 常温下,将pH=11的氨水稀释后,溶液中所有离子的浓度均降低 常温下,将pH=11的NaOH溶液和pH=3的CH3COOH溶液等体积混合后,溶液pH<7 常温下,物质的量浓度和体积相同的K2CO3、K2SO4、HC1溶液混合后,溶液的pH<7

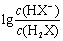 的变化关系 NaHX溶液中c(H+)>C.(OH-) 当混合溶液呈中性时,c(Na+)>C.(HX-)>C.(X-)>c(H+)=C(OH-)
的变化关系 NaHX溶液中c(H+)>C.(OH-) 当混合溶液呈中性时,c(Na+)>C.(HX-)>C.(X-)>c(H+)=C(OH-)
 变化关系 升高溶液温度,可使溶液由a点变到b点 向HX.HY的混合溶液中滴加NaOH溶液至中性时,溶液中c(Na+)=c(X﹣)+c(Y﹣)
变化关系 升高溶液温度,可使溶液由a点变到b点 向HX.HY的混合溶液中滴加NaOH溶液至中性时,溶液中c(Na+)=c(X﹣)+c(Y﹣)