你可能感兴趣的试题
b>0.0l 混合后溶液呈中性 CH3COOH的电离常数Ka=10-9/(b-0.01) 向CH3COOH溶液中滴加NaOH溶液的过程中,水的电离程度逐渐减小
图①表示25℃时,和0.1mol·L-1盐酸滴定20mL 0.1mol·L-1NaOH溶液 图②表示常温下,等量锌粉与足量的等体积等浓度的盐酸反应 图③表示向CaCl2和盐酸的混合溶液中滴加Na2CO3溶液 图④表示向盐酸和醋酸混合溶液中滴入氨水
V.(NaOH)=0时,c(H+)=1×10-2 mol/L V.(NaOH)<10 mL时,不可能存在c(Na+)= V.(NaOH)=10 mL时,c(H+)=1×10-7 mol/L V.(NaOH)>10 mL时,c(Na+)>
V.(NaOH)=10 mL时,c(H+)=1×10-7 mol/L V.(NaOH)>10 mL时,c(Na+)>
V.(NaOH)=0时,c(H+)=0.01 mol•L-1 V.(NaOH)<10 mL时,不可能存在c(Na+)=2c(C2O42-)+c(HC2O4-) V.(NaOH)=10 mL时,c(H+)=1×10-7 mol/L V.(NaOH)>10 mL时,c(Na+)>c(C2O42-)>c(HC2O4-)
某醋酸溶液的pH=a,将此溶液稀释1倍后,溶液的pH=b,则a﹥b 在滴有酚酞的氨水里,加入NH4Cl至溶液恰好无色,则此时溶液的pH<7 常温下,1.0×10-3 mol·L-1盐酸的pH=3.0,1.0×10-8 mol·L-1盐酸的pH=8.0 常温下,若1 mL pH=1的盐酸与100 mLNaOH溶液混合后,溶液的pH=7,则NaOH溶液的pH=11
1mol/L 1.5mol/L 3mol/L 6mol/L
b>0.01 混合后溶液呈中性 CH3COOH的电离常数K.a= 向CH3COOH溶液中滴加NaOH溶液的过程中,水的电离程度逐渐减小
向CH3COOH溶液中滴加NaOH溶液的过程中,水的电离程度逐渐减小
常温下同浓度的强酸、强碱等体积混合后由水电离出的c(H+) =10-7mol·L-l 常温下pH =2的盐酸和pH =12的氨水等体积混合后c(C1-)+c(H+)=c(NH4+)+c(OH-) 常温下0.1 mol.L.-1的Na2A溶液的pH=10,则该溶液中由水电离的c(OH-)= 10 -10 mol.L.-l 常温下向10 mL0.1 mol.L.-1的CH3COOH溶液中滴加相同浓度的氨水,在滴加过程中, 将减小
将减小
取KOH、Ba(OH)2、Ca(OH)2溶液分别与酚酞试液作用,观察溶液颜色 取NaOH、NaCl、HCl溶液分别与酚酞试液作用,观察溶液颜色 向20.00ml滴有酚酞的0.10mol・L.¯1NaOH溶液中,逐滴滴加0.10mol・L.¯1HCl溶液25.00ml,观察溶液颜色变化 向25.00ml滴有酚酞的0.10 mol・L.¯1HCl中,逐滴滴加0.10 mol・L.¯1NaOH溶液20.00ml,观察溶液颜色变化
pH=7时,所加醋酸溶液的体积为10mL pH<7时,溶液中c(CH3COO-)>c(Na+) 7+)>c(CH3COO-)>c(OH-)>c(H+) 继续滴加0.1 mol·L-1醋酸溶液,溶液pH可以变为1
图1可以表示用NaOH溶液滴定1 mol·L-1的稀盐酸 图1可以表示用NaOH溶液滴定1 mol·L-1的稀醋酸 图2可以表示在MgCl2中逐滴加入相同浓度相同体积的NaOH溶液 图2可以表示在稀盐酸中逐滴加入相同浓度相同体积的NaOH溶液 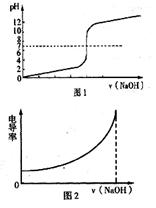
NaOH溶液起始浓度为0. 1 mol·L-1 A.>12.5 B.点溶液中c(Na+)一定等于c(CH3COO-) D.点溶液中: c(Na+)>c(CH3COO-)> c(CH3COOH)>c(H.+)>c(OH-)
常温下,该酸的电离常数K=10-5.6 该测定过程中不可以选择甲基橙为指示剂 离定至①处时,溶液中离子浓度关系为: c(A-)>c(Na+)>c(H+)>c(OH-) 由①到③过程中,水的电离程度先增大后减小
常温下,该酸的电离常数K=10-5.6 该测定过程中不可以选择甲基橙为指示剂 离定至①处时,溶液中离子浓度关系为: c(A-)>c(Na+)>c(H+)>c(OH-) 由①到③过程中,水的电离程度先增大后减小
V(NaOH) = 0时,c(H+) = 1×10-2 mol·L.-1 V(NaOH)<10 mL时,不可能存在c(Na+) = 2c(C2O42 -)+c(HC2O4- ) V(NaOH) = 10 mL时,c(H+) = 1×10-7 mol·L.-1 V(NaOH)>10 mL时,c(Na+)>c(C2O42 -)>c(HC2O4- )
0.01mol/L CH3COOH溶液 0.01mol/L HNO3溶液 pH=2的CH3COOH溶液 pH=2的H2SO4溶液
b>0.01 混合后溶液呈中性 CH3COOH的电离常数K.a= 向CH3COOH溶液中滴加NaOH溶液的过程中,水的电离程度逐渐减小
向CH3COOH溶液中滴加NaOH溶液的过程中,水的电离程度逐渐减小

 V.(NaOH)=10 mL时,c(H+)=1×10-7 mol/L V.(NaOH)>10 mL时,c(Na+)>
V.(NaOH)=10 mL时,c(H+)=1×10-7 mol/L V.(NaOH)>10 mL时,c(Na+)>
 向CH3COOH溶液中滴加NaOH溶液的过程中,水的电离程度逐渐减小
向CH3COOH溶液中滴加NaOH溶液的过程中,水的电离程度逐渐减小
 将减小
将减小

 向CH3COOH溶液中滴加NaOH溶液的过程中,水的电离程度逐渐减小
向CH3COOH溶液中滴加NaOH溶液的过程中,水的电离程度逐渐减小