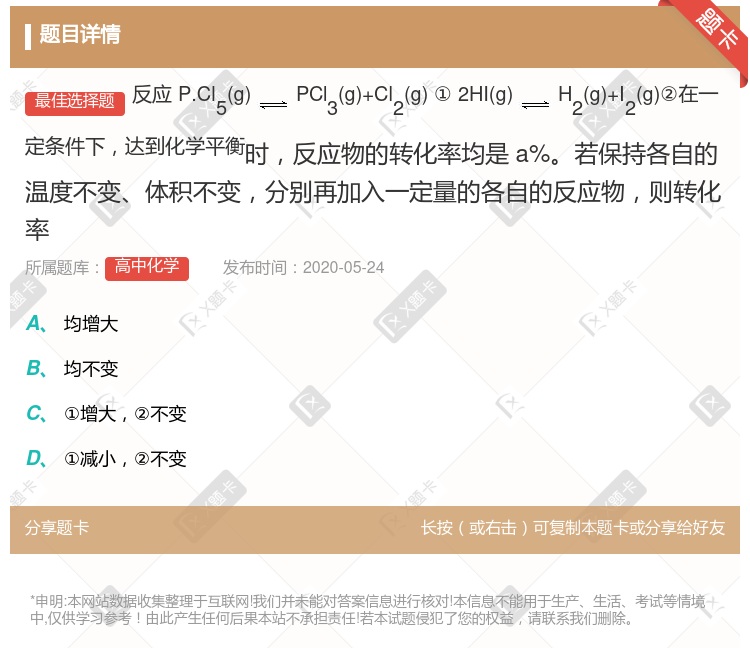
 平衡后移走2.0 mol PCl3和1.0 mol Cl2,在相同条件再达平衡时,c(PCl5)<0.2 mol·L-1
平衡后移走2.0 mol PCl3和1.0 mol Cl2,在相同条件再达平衡时,c(PCl5)<0.2 mol·L-1
 PCl3(g)+C12(g)△H.=-93 kJ·mol-1
PCl3(g)+C12(g)△H.=-93 kJ·mol-1
 PCl3(g)+Cl2(g) △H.=-93 kJ.mol-1
PCl3(g)+Cl2(g) △H.=-93 kJ.mol-1 
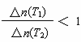 当容器中Cl2为1.2 mol时,反应达到平衡 若升高温度(T.1<T.2)时,该反应平衡常数减小,则平衡时PCl3的 平衡后移走2.0 mol PCl3和1.0 molCl2,在相同条件下再达平衡时,c(PCl5)<0.2 mol/L
当容器中Cl2为1.2 mol时,反应达到平衡 若升高温度(T.1<T.2)时,该反应平衡常数减小,则平衡时PCl3的 平衡后移走2.0 mol PCl3和1.0 molCl2,在相同条件下再达平衡时,c(PCl5)<0.2 mol/L