你可能感兴趣的试题
常温下,等浓度、等体积的NaHCO3 溶液pH小于 溶液pH 常温下,等浓度、等体积的Na2 CO3 溶液和
溶液pH 常温下,等浓度、等体积的Na2 CO3 溶液和  溶液中所含离子总数前者小于后者
溶液中所含离子总数前者小于后者  水杨酸的第二级电离 Ka2 远小于第一级电离Ka1 的原因之一是 能形成分子内氢键
水杨酸的第二级电离 Ka2 远小于第一级电离Ka1 的原因之一是 能形成分子内氢键
等浓度的弱酸和强碱 稀的强酸和稀的强碱 稀的弱酸和浓的强碱 稀的强酸和浓的弱碱
若混合前酸、碱pH之和等于14,则HA一定是弱酸 若混合前酸、碱物质的量浓度相同,则BOH一定是弱碱 溶液中水的电离程度:混合溶液>纯水>BOH溶液 混合溶液中离子浓度一定满足:c(B+)>c(A-)>c(H+)>c(OH-)
常温下,HA的电离常数K(HA)约为10-5 v1<20 溶液中水的电离程度:a点>b点 滴定过程为了确定滴定终点,最合适的指示剂是酚酞
常温下,等浓度、等体积的NaHCO3 溶液pH小于 溶液pH 常温下,等浓度、等体积的Na2 CO3 溶液和
溶液pH 常温下,等浓度、等体积的Na2 CO3 溶液和 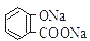 溶液中所含离子总数前者小于后者
溶液中所含离子总数前者小于后者 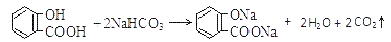 水杨酸的第二级电离 Ka2 远小于第一级电离Ka1 的原因之一是 能形成分子内氢键
水杨酸的第二级电离 Ka2 远小于第一级电离Ka1 的原因之一是 能形成分子内氢键
0.1 mol·L-1 HR溶液的pH为5 HR为弱酸,常温时随着氨气的通入,  逐渐增大 当通入0.1 mol NH3时, c(NH4+)>c(R-)>c(OH-)>c(H+) 当c(R-)= c(HR)时,溶液必为中性
逐渐增大 当通入0.1 mol NH3时, c(NH4+)>c(R-)>c(OH-)>c(H+) 当c(R-)= c(HR)时,溶液必为中性
从甲组情况分析,若a=7,则HX为强酸;若a>7,则HX为弱酸 在乙组混合溶液中,离子浓度c(X-)=c(Na+) 从丙组实验结果分析,HX是弱酸 丁组实验所得混合溶液中,由水电离出的c(OH-)=10-10 mol/L
碳酸的酸性强于氢硫酸 多元弱酸的酸性主要由第一步电离决定 多元弱酸的各步电离之间无影响 向弱酸溶液中加少量NaOH固体,电离常数不变
常温下,该酸的电离常数K=10-5.6 该测定过程中不可以选择甲基橙为指示剂 离定至①处时,溶液中离子浓度关系为: c(A-)>c(Na+)>c(H+)>c(OH-) 由①到③过程中,水的电离程度先增大后减小

 溶液pH 常温下,等浓度、等体积的Na2 CO3 溶液和
溶液pH 常温下,等浓度、等体积的Na2 CO3 溶液和  溶液中所含离子总数前者小于后者
溶液中所含离子总数前者小于后者  水杨酸的第二级电离 Ka2 远小于第一级电离Ka1 的原因之一是 能形成分子内氢键
水杨酸的第二级电离 Ka2 远小于第一级电离Ka1 的原因之一是 能形成分子内氢键
 溶液pH 常温下,等浓度、等体积的Na2 CO3 溶液和
溶液pH 常温下,等浓度、等体积的Na2 CO3 溶液和 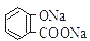 溶液中所含离子总数前者小于后者
溶液中所含离子总数前者小于后者 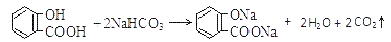 水杨酸的第二级电离 Ka2 远小于第一级电离Ka1 的原因之一是 能形成分子内氢键
水杨酸的第二级电离 Ka2 远小于第一级电离Ka1 的原因之一是 能形成分子内氢键
 逐渐增大 当通入0.1 mol NH3时, c(NH4+)>c(R-)>c(OH-)>c(H+) 当c(R-)= c(HR)时,溶液必为中性
逐渐增大 当通入0.1 mol NH3时, c(NH4+)>c(R-)>c(OH-)>c(H+) 当c(R-)= c(HR)时,溶液必为中性