你可能感兴趣的试题
CH4、NH3、H2O、HF HF、H2O、NH3、CH4 H2O、HF、CH4、NH3 HF、H2O、CH4、NH3、
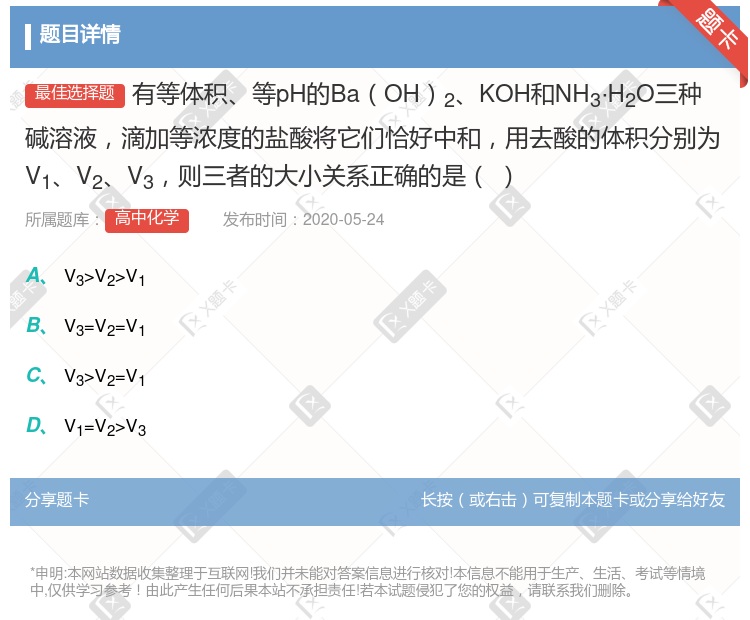
V.3>V.2>V.1 V.3=V2=V1 V.3>V.2=V1 V.1=V2>V.3
[Cu(NH3)4]SO4·H2O [Ag(NH3)2]OH KAl(SO4)2·12H2O Na[Al(OH)4]
HCO3-的电离方程式:HCO3-+ H2O  H2CO3 + OH- NH3·H2O的电离方程式:NH3·H2O
H2CO3 + OH- NH3·H2O的电离方程式:NH3·H2O NH4+ + OH- CO32-的水解方程式: CO32- + 2H2O
NH4+ + OH- CO32-的水解方程式: CO32- + 2H2O H2CO3 + 2OH- NH4Cl的水解方程式:NH4+ + H2O===NH3·H2O + H+
H2CO3 + 2OH- NH4Cl的水解方程式:NH4+ + H2O===NH3·H2O + H+
同物质的量浓度的三种溶液的pH:a>b>c 同pH时,三种溶液稀释相同倍数后,pH:a<b<c 同pH、同体积的三种溶液消耗同浓度盐酸的体积:a=b=c 同pH时,稀释不同倍数、pH仍相同,三种溶液稀释的倍数:a>b>c
降低温度,溶液中c(NH4+)增大 加入少量NaOH固体,平衡向逆反应方向移动,电离平衡常数减小 加入少量0.1 mol·L-1 HCl溶液,溶液中c(OH-)增大 加入水时,溶液中c(OH-) / c(NH3·H2O) 增大
V3>V2>V1 V3=V2=V1 V3>V2=V1 V1=V2>V3
V3> V2> V1 V3 = V2 = V1 V3> V2 = V1 V1 = V2 > V3
c(NH ):③>① 水电离出的c(H+):②>① ①和②等体积混合后的溶液:c(H+)=c(OH-)+c(NH3·H2O) ①和③等体积混合后的溶液:c(NH
):③>① 水电离出的c(H+):②>① ①和②等体积混合后的溶液:c(H+)=c(OH-)+c(NH3·H2O) ①和③等体积混合后的溶液:c(NH )>c(Cl-)>c(OH-)>c(H+)
)>c(Cl-)>c(OH-)>c(H+)
M.点溶液中存在:c(H+)=c(OH-)+c(NH3·H2O)+ c(NH4+) N、Q.两点溶液中NH3 • H2O的电离常数:N P 点氨水过量,c(NH4+)> c(Cl-) a=0.054
同物质的量浓度的三种溶液的pH:a>b>c 同pH时,三种溶液稀释相同倍数后的pH:a同pH、同体积的三种溶液消耗同浓度盐酸的体积:a=b=c 同pH时,稀释不同倍数后pH仍相同,三种溶液稀释的倍数:a>b>c
同物质的量浓度的三种溶液的pH:a=b>c 同pH时,三种溶液稀释相同倍数后,pH:a=b<c 同pH、同体积的三种溶液消耗同浓度盐酸的体积:a=b=c 同pH时,稀释不同倍数、pH仍相同,三种溶液稀释的倍数:a>b>c
同物质的量浓度的三种溶液的pH:a>b>c 同pH时,三种溶液稀释相同倍数后,pH:a=b<c 同pH、同体积的三种溶液消耗同浓度盐酸的体积:a=b=c 同pH时,稀释不同倍数、pH仍相同,三种溶液稀释的倍数:a>b>c
由甲可知,A.与 在有催化剂存在的热化学方程式为:  B.常温常压下,将a mol CO2气体通入1L bmol/L的NaOH溶液中,当a=2b时,随着CO2气体的通入,溶液中由水电离出的c(H.+)有如图乙变化关系;当1/2<a/b<1时,所得溶液中一定存在: c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) 常温下,将稀NaOH溶液与CH3COOH溶液混合,不可能出现pH>7, 且c(OH-)>c(Na+)>c(H+)>c(CH3COO-)的情况 某温度下,pH=11的NH3·H2O和pH=1的盐酸等体积混合后(不考虑混合后溶液体积的变化)恰好完全反应,反应后的溶液中NH4+、NH3·H2O与NH3三种微粒的平衡浓度之和为0.05mol·L-1
B.常温常压下,将a mol CO2气体通入1L bmol/L的NaOH溶液中,当a=2b时,随着CO2气体的通入,溶液中由水电离出的c(H.+)有如图乙变化关系;当1/2<a/b<1时,所得溶液中一定存在: c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) 常温下,将稀NaOH溶液与CH3COOH溶液混合,不可能出现pH>7, 且c(OH-)>c(Na+)>c(H+)>c(CH3COO-)的情况 某温度下,pH=11的NH3·H2O和pH=1的盐酸等体积混合后(不考虑混合后溶液体积的变化)恰好完全反应,反应后的溶液中NH4+、NH3·H2O与NH3三种微粒的平衡浓度之和为0.05mol·L-1
CO2属非极性分子,H2O、NH3属极性分子 CO2、NH3属非极性分子,H2O属极性分子 三者均是极性分子 它们均是非极性分子
0.01mol/L NH4Al(SO4)2溶液与0.02 mol/LBa(OH)2溶液等体积混合产生沉淀: NH4++Al3++2SO42−+2Ba2++4OH−=2BaSO4↓+ Al(OH)3↓+NH3·H2O NH4HCO3溶液与足量Ba(OH)2溶液混合:HCO3-+Ba2++OH-=BaCO3↓+H2O 向NaHCO3溶液中加入过量的澄清石灰水,出现白色沉淀: 2HCO3-+Ca2++2OH-=CaCO3↓+CO32-+2H2O 向FeCl3溶液中加入Na2S溶液产生沉淀:2Fe3++3S2-+6H2O=2Fe(OH)3↓+3H2S↑
 H2CO3 + OH- NH3·H2O的电离方程式:NH3·H2O
H2CO3 + OH- NH3·H2O的电离方程式:NH3·H2O NH4+ + OH- CO32-的水解方程式: CO32- + 2H2O
NH4+ + OH- CO32-的水解方程式: CO32- + 2H2O H2CO3 + 2OH- NH4Cl的水解方程式:NH4+ + H2O===NH3·H2O + H+
H2CO3 + 2OH- NH4Cl的水解方程式:NH4+ + H2O===NH3·H2O + H+
 ):③>① 水电离出的c(H+):②>① ①和②等体积混合后的溶液:c(H+)=c(OH-)+c(NH3·H2O) ①和③等体积混合后的溶液:c(NH
):③>① 水电离出的c(H+):②>① ①和②等体积混合后的溶液:c(H+)=c(OH-)+c(NH3·H2O) ①和③等体积混合后的溶液:c(NH )>c(Cl-)>c(OH-)>c(H+)
)>c(Cl-)>c(OH-)>c(H+)
 B.常温常压下,将a mol CO2气体通入1L bmol/L的NaOH溶液中,当a=2b时,随着CO2气体的通入,溶液中由水电离出的c(H.+)有如图乙变化关系;当1/2<a/b<1时,所得溶液中一定存在: c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) 常温下,将稀NaOH溶液与CH3COOH溶液混合,不可能出现pH>7, 且c(OH-)>c(Na+)>c(H+)>c(CH3COO-)的情况 某温度下,pH=11的NH3·H2O和pH=1的盐酸等体积混合后(不考虑混合后溶液体积的变化)恰好完全反应,反应后的溶液中NH4+、NH3·H2O与NH3三种微粒的平衡浓度之和为0.05mol·L-1
B.常温常压下,将a mol CO2气体通入1L bmol/L的NaOH溶液中,当a=2b时,随着CO2气体的通入,溶液中由水电离出的c(H.+)有如图乙变化关系;当1/2<a/b<1时,所得溶液中一定存在: c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) 常温下,将稀NaOH溶液与CH3COOH溶液混合,不可能出现pH>7, 且c(OH-)>c(Na+)>c(H+)>c(CH3COO-)的情况 某温度下,pH=11的NH3·H2O和pH=1的盐酸等体积混合后(不考虑混合后溶液体积的变化)恰好完全反应,反应后的溶液中NH4+、NH3·H2O与NH3三种微粒的平衡浓度之和为0.05mol·L-1