你可能感兴趣的试题
B.两种酸溶液各1mL,分别加水稀释到1000 mL,其溶液的pH与溶液体积(V.)的关系如图所示,则下列说法正确的是  A.A. 两种酸溶液的物质的量浓度一定相等 B.稀释后A.酸溶液的酸性比B.酸溶液强 a=5时,A.是弱酸,B.是强酸 若A.B.都是弱酸,则5>a>2
A.A. 两种酸溶液的物质的量浓度一定相等 B.稀释后A.酸溶液的酸性比B.酸溶液强 a=5时,A.是弱酸,B.是强酸 若A.B.都是弱酸,则5>a>2
HA是一种强酸 x点,c(A-)=c(B-) HB是一种弱酸 原溶液中HA的物质的量浓度为HB的10倍
B.两种酸溶液各取1mL,分别加水稀释到1 000mL,其溶液的pH与溶液体积(V)的关系如图所示,则下列说法不正确的是 A.稀释后A.溶液的酸性比 溶液弱 B.a=5时,A.是强酸,B.是弱酸 若A.B.都是弱酸,则5>a>2 A.B.两种酸溶液物质的量浓度一定相等
HA.HB都是弱酸 在M.点,c( )=c(
)=c(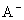 ) 稀释前,c(HA)=10c(HB) 在M.点,HA.HB酸的电离常数相同
) 稀释前,c(HA)=10c(HB) 在M.点,HA.HB酸的电离常数相同
HB和pH=12的碱溶液MOH各1mL,分别加水稀释到1 000mL,其pH的变化与溶液体积的关系如图,下列说法错误的是 A.HA为强酸,HB为弱酸 若b+c=14,则MOH为弱碱 若c=9,则稀释后的三种溶液中,由水电离的氢离子的浓度的大小顺序为HA>MOH>HB 若c=9,将稀释后的HA溶液和MOH溶液取等体积混合,则所得溶液中c(A.﹣)=c(M+)
同温、同浓度的钠盐溶液PH:NaA>NaB PH相同的HA,HB的酸溶液,稀释相同倍数后,PH:HA<HB 中和等体积、等PH的HA,HB溶液时,HA消耗NaOH的物质的量多 同温、同浓度的两种酸溶液,HA的电离程度大于HB的电离程度
HA是一种强酸 原溶液中HA的物质的量浓度为HB的10倍 x点,HB未完全电离 x点,c(A-)=c(B-)
HA是一种强酸 x点,[A-]=[B-] HB是一种弱酸 原溶液中HA的物质的量浓度为HB的10倍 
等物质的量浓度的HA溶液与NaB溶液等体积的混合液中: 2c(Na+) =c(A-)+c(B-)+c(HA)+c(HB) pH相等的NaA与KB两溶液中:[c(Na+)-c(A-)] < [c(K+)-c(B-)] pH=9的三种溶液 ①NaB ②NH3·H2O ③NaOH中由水电离出的c(OH-):①>②>③ 两种溶液① 0.1mol/L HA溶液 ②0.1mol/L HB溶液,加水稀释至pH 相同,需加水的量前者小于后者
H HC的钠盐分别为NaA.NaB.NaC,它们的物质的量浓度相同时, 溶液的PH依次为9,10,8.则这三种弱酸的酸性由强到弱的顺序是( ) A.HA>HB>HC B.HB>HA>HC HC>HB>HA HC>HA>HB
HA的酸性比HB的酸性弱 a点溶液的导电性比c点溶液的导电性弱 若两溶液无限稀释,则它们的c(H+)相等 对a、b两点溶液同时升高温度,则 增大
增大
B.两种酸溶液各1mL, 分别加水稀释到1000mL,其溶液的pH与溶液体积(V)的关系如右图所示, 则下列说法正确的是 ( )  A.A. 两种酸溶液物质的量浓度一定相等 B.稀释后A.酸溶液的酸性比B.酸溶液强 a = 5时,A.是弱酸,B.是强酸 若A.B.都是弱酸, 则5 > a > 2
A.A. 两种酸溶液物质的量浓度一定相等 B.稀释后A.酸溶液的酸性比B.酸溶液强 a = 5时,A.是弱酸,B.是强酸 若A.B.都是弱酸, 则5 > a > 2
若HA.HB均为弱酸,酸性:HA>HB,则相同条件下,溶液的pH大小为NaA>NaB 相同条件下,将pH=11的NaOH溶液和和氨水分别稀释pH=9的溶液,所加水的体积前者大 pH=3的醋酸与pH=1的NaOH溶液等体积混合时,溶液中离子浓度的大小顺序是:c(Na+)>c(CHCOO-)>c(OH-)>c(H+) 0.1mol/L的某二元弱酸盐Na2A溶液中,c(Na+)=2[c(HA-)+c(A2-)+c(H2A.)]
HB是一种弱酸 稀释前,c(HA)<10c(HB) 在NaB和HB的混合溶液中一定存在: c(B-)>c(Na+)>c(H+)>c(OH-) 在M.点的两种溶液中: c(B-)=c(A-),且c(B-)+c(H+)>c(A-)+c(OH-) 
HB两种酸溶液各1 mL,分别加水稀释到1000 mL,其pH与溶液体积V.的关系如图所示,其中A.代表酸HA, 代表酸HB.下列说法正确的是 A.稀释前两酸溶液的物质的量浓度相等 B.稀释后,HA酸溶液的酸性比HB酸溶液强 a=5时,HA是强酸,HB是弱酸 若有等浓度的NaA溶液和NaB溶液,则溶液的碱性NaA>NaB
室温下,pH相同、体积相同的醋酸和盐酸两种溶液分别加水稀释2倍后,两溶液的酸性都减弱,其中,稀释后的盐酸的酸性还是比醋酸的强。 室温下,pH相同、体积相同的氨水和氢氧化钠两种溶液分别加水稀释2倍后,两溶液的pH均减小,其中,稀释后的氢氧化钠的pH比氨水的小。 室温时,0.01 mol·L.-1醋酸溶液的pH=2 室温,0.01 mol·L.-1醋酸溶液中加入等体积0.01 mol·L.-1 NaOH溶液后,所得溶液的pH=7
HB各1 mL,分别加水稀释到1000 mL,其pH与溶液体积(V.)的关系如图所示,下列说法不正确的是  A.同浓度、同体积的HA.HB溶液分别加入过量的锌粒,产生的氢气体积后者大 物质的量浓度HA若1体积相同pH均为1的HA.HB溶液分别滴加同浓度的NaOH溶液至中性,前者消耗的NaOH少
A.同浓度、同体积的HA.HB溶液分别加入过量的锌粒,产生的氢气体积后者大 物质的量浓度HA若1体积相同pH均为1的HA.HB溶液分别滴加同浓度的NaOH溶液至中性,前者消耗的NaOH少
B.两种酸的溶液各1 mL,分别加水稀释到1 000 mL,各自的pH与溶液体积V.的关系如图所示,下列说法正确的是( )  A.A. 两种酸的溶液的物质的量浓度一定相等 B.稀释后,A.酸溶液的酸性比B.酸溶液的酸性强 a=5时,A.是弱酸,B.是强酸 若A.B.都是弱酸,则5>a>2
A.A. 两种酸的溶液的物质的量浓度一定相等 B.稀释后,A.酸溶液的酸性比B.酸溶液的酸性强 a=5时,A.是弱酸,B.是强酸 若A.B.都是弱酸,则5>a>2
B.两种酸溶液各lmL,分别加水稀释到1000 mL,其溶液的pH与溶液体积(V)的关系如图所示,则下列说法正确的是( ) A.A. 两种酸溶液物质的量浓度一定相等 B.稀释后A.酸溶液的酸性比B.酸溶液强 a=5时,A.是弱酸,B.是强酸 若A.B.都是弱酸,则5>a>2 

 A.A. 两种酸溶液的物质的量浓度一定相等 B.稀释后A.酸溶液的酸性比B.酸溶液强 a=5时,A.是弱酸,B.是强酸 若A.B.都是弱酸,则5>a>2
A.A. 两种酸溶液的物质的量浓度一定相等 B.稀释后A.酸溶液的酸性比B.酸溶液强 a=5时,A.是弱酸,B.是强酸 若A.B.都是弱酸,则5>a>2
 )=c(
)=c(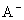 ) 稀释前,c(HA)=10c(HB) 在M.点,HA.HB酸的电离常数相同
) 稀释前,c(HA)=10c(HB) 在M.点,HA.HB酸的电离常数相同

 增大
增大
 A.A. 两种酸溶液物质的量浓度一定相等 B.稀释后A.酸溶液的酸性比B.酸溶液强 a = 5时,A.是弱酸,B.是强酸 若A.B.都是弱酸, 则5 > a > 2
A.A. 两种酸溶液物质的量浓度一定相等 B.稀释后A.酸溶液的酸性比B.酸溶液强 a = 5时,A.是弱酸,B.是强酸 若A.B.都是弱酸, 则5 > a > 2

 A.同浓度、同体积的HA.HB溶液分别加入过量的锌粒,产生的氢气体积后者大 物质的量浓度HA
A.同浓度、同体积的HA.HB溶液分别加入过量的锌粒,产生的氢气体积后者大 物质的量浓度HA A.A. 两种酸的溶液的物质的量浓度一定相等 B.稀释后,A.酸溶液的酸性比B.酸溶液的酸性强 a=5时,A.是弱酸,B.是强酸 若A.B.都是弱酸,则5>a>2
A.A. 两种酸的溶液的物质的量浓度一定相等 B.稀释后,A.酸溶液的酸性比B.酸溶液的酸性强 a=5时,A.是弱酸,B.是强酸 若A.B.都是弱酸,则5>a>2
