你可能感兴趣的试题
该溶液中,K+、Fe2+、C6H5OH、Br- 可以大量共存 和KI溶液反应的离子方程式:Fe3++2I -= Fe2++I2 和Ba(OH)2溶液反应的离子方程式:Fe3++SO42-+Ba2++3OH-=Fe(OH)3↓+BaSO4↓ 1L 0.1mol·L-1该溶液和足量的Zn充分反应,生成11.2g Fe
反应I2(aq)+I-(aq) I-(aq)的△H>0 利用该反应可以除去硫粉中少量的碘单质 在上述平衡体系中加入苯,平衡不移动 25℃时,向溶液中加入少量KI固体,平衡常数K.小于680
I-(aq)的△H>0 利用该反应可以除去硫粉中少量的碘单质 在上述平衡体系中加入苯,平衡不移动 25℃时,向溶液中加入少量KI固体,平衡常数K.小于680
该溶液中,K+、Fe2+、C6H5OH、Br-可以大量共存 和KI溶液反应的离子方程式:Fe3++2I-===Fe2++I2 和Ba(OH)2溶液反应的离子方程式:Fe3++SO +Ba2++3OH-===Fe(OH)3↓+ BaSO4↓ 1 L 0.1 mol·L-1该溶液和足量的Zn充分反应,生成11.2 g Fe
+Ba2++3OH-===Fe(OH)3↓+ BaSO4↓ 1 L 0.1 mol·L-1该溶液和足量的Zn充分反应,生成11.2 g Fe
用白醋除铁锈:Fe2O3·xH2O+6H+= (3+x)H2O+2Fe3+ 用惰性电极电解MgCl2溶液:2Cl-+2H2O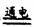 Cl2↑+H2↑+2O.H- 酸性溶液中KIO3与KI反应:I- + IO3- + 6H+ == I2 + 3H2O 碘化亚铁溶液与少量氯气反应:2I- + Cl2 = I2 + 2Cl-
Cl2↑+H2↑+2O.H- 酸性溶液中KIO3与KI反应:I- + IO3- + 6H+ == I2 + 3H2O 碘化亚铁溶液与少量氯气反应:2I- + Cl2 = I2 + 2Cl-
Fe3+ 
Cl2 HNO2
反应 I2(aq)+I.-(aq) I3-(aq) ΔH.>0 若温度为T1、T2,反应的平衡常数分别为K1、K2, 则K2>K1 若T1时,反应进行到状态d时,一定有υ正 >υ逆 状态a与状态b相比,状态b时I2的转化率更高
I3-(aq) ΔH.>0 若温度为T1、T2,反应的平衡常数分别为K1、K2, 则K2>K1 若T1时,反应进行到状态d时,一定有υ正 >υ逆 状态a与状态b相比,状态b时I2的转化率更高
该溶液中,K+、Fe2+、C6H5OH、Br-可以大量共存 和KI溶液反应的离子方程式:Fe3++2I-==Fe2++I2 和Ba(OH)2溶液反应的离子方程式: Fe3++SO42-+Ba2++3OH-==Fe(OH)3↓+BaSO4↓ 1L0.1mol·L-1该溶液和足量的Zn充分反应,生成11.2gFe
氧化性(酸性溶液):FeCl3 > Co(OH)3 > I2 还原性(碱性溶液):Fe(OH)2 > I2 > KIO3 热稳定性:NaCl > NaClO4 > NaClO 酸性(水溶液):HSCN > H2CO3 > HCN
I.—、Fe3+ 、Cl— Fe2+、Cl—、Br‑ Fe2+、Fe3+ 、Cl— Fe2+、I.— 、Cl—
图中AB段的氧化剂为K2Cr2O7 图中BC段发生的反应为2Fe3++2I- =2Fe2++I2 开始加入的K2Cr2O7为0.25 mol K2Cr2O7可与FeSO4反应的物质的量为1:3。
该溶液中,K+、Fe2+、C6H5OH、Br-可以大量共存 和KI溶液反应的离子方程式:Fe3++2I-=Fe2++I2 和Ba(OH)2溶液反应的离子方程式:Fe3++SO42-+Ba2++3OH-=Fe(OH)3↓+BaSO4↓ 1 L 0.1 mol·L-1该溶液和足量的Zn充分反应,生成11.2 g Fe
I2+2Fe2+===2Fe3++2I- 2Br-+I2===Br2+2I- 2Fe3++2I-===2Fe2++I2 2Fe3++2Br-===2Fe2++Br2
图中AB段的氧化剂为K2Cr2O7 图中BC段发生的反应为2Fe3++2I﹣=2Fe2++I2 开始加入的K2Cr2O7为0.25 mol K2Cr2O7可与FeSO4反应的物质的量为1:3
图中AB段的氧化剂为K2Cr2O7 图中BC段发生的反应为2Fe3++2I- =2Fe2++I2 开始加入的K2Cr2O7 为0.25 mol 开始加入的K2Cr2O7 与FeSO4的物质的量比为1:3
该溶液中,K+、Fe2+、C6H5OH、Br-可以大量共存
和KI溶液反应的离子方程式:Fe3+ + 2I-= Fe2+ + I2 和Ba(OH)2溶液反应的离子方程式:Fe3+ + SO42-+ Ba2+ + 3OH-= Fe(OH)3↓+ BaSO4↓
1L0.1mol/L该溶液和足量的Zn充分反应,生成 11.2gFe
2Fe3++I2=2Fe2++2I- 2Fe3++2I-=2Fe2++I2 2Fe2++2I-=2Fe3++I2 2Fe2++I2=2Fe3++2I-

 I-(aq)的△H>0 利用该反应可以除去硫粉中少量的碘单质 在上述平衡体系中加入苯,平衡不移动 25℃时,向溶液中加入少量KI固体,平衡常数K.小于680
I-(aq)的△H>0 利用该反应可以除去硫粉中少量的碘单质 在上述平衡体系中加入苯,平衡不移动 25℃时,向溶液中加入少量KI固体,平衡常数K.小于680
 +Ba2++3OH-===Fe(OH)3↓+ BaSO4↓ 1 L 0.1 mol·L-1该溶液和足量的Zn充分反应,生成11.2 g Fe
+Ba2++3OH-===Fe(OH)3↓+ BaSO4↓ 1 L 0.1 mol·L-1该溶液和足量的Zn充分反应,生成11.2 g Fe
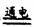 Cl2↑+H2↑+2O.H- 酸性溶液中KIO3与KI反应:I- + IO3- + 6H+ == I2 + 3H2O 碘化亚铁溶液与少量氯气反应:2I- + Cl2 = I2 + 2Cl-
Cl2↑+H2↑+2O.H- 酸性溶液中KIO3与KI反应:I- + IO3- + 6H+ == I2 + 3H2O 碘化亚铁溶液与少量氯气反应:2I- + Cl2 = I2 + 2Cl-

 I3-(aq) ΔH.>0 若温度为T1、T2,反应的平衡常数分别为K1、K2, 则K2>K1 若T1时,反应进行到状态d时,一定有υ正 >υ逆 状态a与状态b相比,状态b时I2的转化率更高
I3-(aq) ΔH.>0 若温度为T1、T2,反应的平衡常数分别为K1、K2, 则K2>K1 若T1时,反应进行到状态d时,一定有υ正 >υ逆 状态a与状态b相比,状态b时I2的转化率更高