你可能感兴趣的试题
氢离子浓度相等 H2SO4和HAc的浓度相等 H2SO4的浓度为HAc浓度的1/2 H2SO4和HAc的电离度相等
铁片上发生氧化反应Fe 3e- == Fe3+ 铜片上发生还原反应 2H++2e- =H2 铜片上发生氧化反应 Cu2e- == Cu2+ 溶液中NO3-的浓度基本不变
用导线将铁片和铜片连接后,放入一盛有稀 H2SO4溶液的烧杯中 将铁片直接放入一盛有稀 H2SO4溶液的烧杯中 Cu片作阳极,铁片作阴极,电解一定量的H2SO4溶液 Cu片作阴极,铁片作阳极,电解一定量的H2SO4溶液
Zn|H2SO4(稀)|C Cu|HNO3(稀)|Ag Zn|CCl4|Cu Fe|H2SO4(稀)|Fe
用导线将铁片和铜片连接后,放入一盛有稀 H2SO4溶液的烧杯中 Cu片作阳极,铁片作阴极,电解一定量的H2SO4溶液 Cu片作阴极,铁片作阳极,电解一定量的H2SO4溶液 将铁片直接放入一盛有稀 H2SO4溶液的烧杯中
B.C.D.四块金属片,进行如下实验,①A. 用导线相连后,同时插入稀H2SO4中,A.极为负极 ② D.用导线相连后,同时浸入稀H2SO4中,电子由C.→导线→ ③A.C.相连后,同时浸入稀H2SO4,C.极产生大量气泡 ④B.D.相连后,同时浸入稀H2SO4中,D.极发生氧化反应,则四种金属的活动性顺序为: A.A.>B.>C.>DB.C.>A.>B.>DC.A.>C.>D.>BD.B.>D.>C.>A
正极附近C.(H+)逐渐增大 正极上产生气泡 正极、负极附近C.(H+)基本不变 Zn片、Cu片同时冒出气泡,则说明Zn片不纯
该装置中电子由Zn极流向Cu极,溶液中的SO42-通过盐桥移向Zn极 将上述装置中的Zn棒和Cu棒同时浸入CuSO4溶液,电流 计的指针偏转幅度变小,且很快减弱 将烧杯内溶液对换,电流计指针也能发生偏转 将盐桥改为铜导线连接两种溶液,电流由Cu极移向Zn极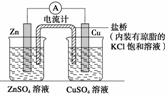
c(H2SO4)=c(HAc) c(H2SO4)=2c(HAc) 2c(H2SO4)=c(HAc) 4c(H2SO4)=c(HAc)
Zn | H2SO4(稀) | C. Cu | 酒精 | Ag Zn | CCl4 | Cu Fe | H2SO4(稀) | Fe
c(H2SO4)=c(HAc) c(H2SO4)=2c(HAc) 2c(H2SO4)=c(HAc) 4c(H2SO4)=c(HAc)
HCl和Na2CO3溶液反应, HCl溶液和CaCO3反应 足量稀H2SO4和Na2CO3溶液反应, 足量稀HNO3和K2CO3溶液反应 稀H2SO4和Ba(OH)2溶液反应, 稀H2SO4和KOH溶液反应 BaCO3和稀 H2SO4溶液反应, BaCO3和稀HCl 溶液反应
正极附近SO2- 4浓度逐渐增大 电子通过导线由铜片流向锌片 负极反应式为Zn-2e-=Zn2+ 该原电池工作过程中电解质溶液的pH增大
正极附近SO42―的浓度逐渐增大 负极附近SO42―的浓度逐渐减小 负极附近SO42―的浓度逐渐增大 正极附近SO42―的浓度基本不变
H.+被氧化 SO42﹣向正极移动 Cu片逐渐溶解 溶液酸性减弱
正极附近SO42-的浓度逐渐增大 负极附近SO42-的浓度逐渐减小 负极附近SO42- 的浓度逐渐增大 正负极附近SO42-的浓度基本不变
B.C.D.四块金属片,进行如下实验: ①A. 用导线连接后,同时浸入稀H2SO4溶液中,A.极为负极 ② D.用导线连接后,同时浸入稀H2SO4溶液中,电流由 →导线→C ③A.C.用导线连接后,同时浸入稀H2SO4溶液中,C.极上产生大量气泡 ④B.D.用导线连接后,同时浸入稀H2SO4溶液中,D.极上发生氧化反应据此,判断四种金属的活动性顺序是( ) A.A.>B.>C.>D. B.C.>A.>B.>D. C.A.>C.>D.>B. D.B.>D.>C.>A.
氢离子浓度(单位:mol/L下同)相等 H2SO4和HAC的浓度相等 H2SO4的浓度为HAC的浓度的1/2 H2SO4和HAC的电离度相等

