你可能感兴趣的试题
电离平衡常数越小,表示弱电解质的电离能力越弱 电离平衡常数与温度无关 不同浓度的同一弱电解质,其电离平衡常数不同 多元弱酸各步电离平衡常数相互关系为:K1〈K2〈K3
不同浓度的同一弱电解质,其电离平衡常数(K.)不同 电离平衡常数(K.)越小,表示弱电解质电离能力越弱 多元弱酸各步电离平衡常数相互关系为:K.1<K.2<K.3 CH3COOH溶液中加入少量CH3COONa溶液,电离常数减小
化学反应速率v 化学平衡常数K. 水的离子积常数Kw 弱酸的电离常数Ka
电离常数越小,表示弱电解质的电离能力越弱 电离常数与温度无关 不同浓度的同一弱电解质,其电离常数不同 多元弱酸各步电离常数相互关系K1<K2<K3
CH3COONa NaClO Na2CO3 Na3PO4
纯水它能微弱的电离出H+和OH- 25℃时,纯水电离出的H+和OH-浓度相等 25℃时,水的离子积常数为1³10-14 25℃时,水的离子积常数为1³10-7
电离常数越小,pH值越低 电离常数越小,pH值越高 不论弱酸的电离常数多大,pH值一定
在18℃时溶解度比25℃时小 电离是一个放热过程 温度高时电离度变大 温度低时溶液中的氢离子浓度变大
电离平衡常数(K.)与温度无关 H2CO3的电离常数表达式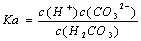 同温下,电离平衡常数越小表示弱电解质电离能力越弱 多元弱酸各步电离平衡常数相互关系为:K123
同温下,电离平衡常数越小表示弱电解质电离能力越弱 多元弱酸各步电离平衡常数相互关系为:K123
碳酸的酸性强于氢硫酸 多元弱酸的酸性主要由第一步电离决定 多元弱酸的各步电离之间无影响 向弱酸溶液中加少量NaOH固体,电离常数不变
电离常数(K.)越小,表示弱电解质电离能力越弱 电离常数(K.)与温度无关 不同浓度的同一弱电解质,其电离常数(K.)不同 多元弱酸各步电离常数相互关系为K.123
等物质的量浓度的各溶液的pH关系为:pH(CH3COONa)>pH(Na2S)>pH(NaCN) a mol/L HCN溶液与b mol/L NaOH溶液等体积混合,所得溶液中c(Na+)>c(CN-),则a一定大于b NaHS和Na2S的混合溶液中,一定存在c(Na+)+c(H+)=c(OH-)+c(HS-)+2c(S2-) 某浓度的HCN溶液的pH=d,则其中c(OH-)=10-d mol/L
在18℃时溶解度比25℃小 的电离过程是放热过程 温度高时电离度变大 温度低时溶液中的氢离子浓度变大
等物质的量浓度的各溶液pH关系为:pH(CH3COONa)> pH(Na2S) > pH(NaCN) a mol/LHCN溶液与b mol/LNaOH溶液等体积混合,所得溶液中c(Na+)>c(CN-),则a一定大于b NaHS和Na2S的混合溶液中,一定存在c(Na+)+c(H+)=c(OH-)+c(HS-)+2c(S2-) 某浓度的NaCN溶液的pH=d,则其中由水电离出的c(OH-)=10-dmol/L
电离度越大,电离平衡常数越大; 浓度越稀,电离度越大,电离平衡常数越大; 在相同的温度下电离度可变,而电离平衡常数不变; 多元弱酸的每一步电离平衡常数是相同的

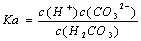 同温下,电离平衡常数越小表示弱电解质电离能力越弱 多元弱酸各步电离平衡常数相互关系为:K1
同温下,电离平衡常数越小表示弱电解质电离能力越弱 多元弱酸各步电离平衡常数相互关系为:K1