你可能感兴趣的试题
Fe3O4溶于足量稀HNO3:Fe3O4+8H+=Fe2++2Fe3++4H2O 等物质的量的MgCl2、Ba(OH)2 和 HC1 溶液混合:Mg2++2OH-= Mg(OH)2↓ 将过量的SO2通入Ca(ClO)2溶液中: SO2+ClO-+H2O =HClO+ HSO3- 将0.2 mol·L-1的NH4Al(SO4)2溶液与0.3 mol·L-1的Ba(OH)2溶液等体积混合: 2Al3++3SO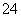 +3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓
+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓
将HBr通入酸性KMnO4溶液,溶液颜色由紫红色变成无色 Fe(NO3)2溶液中存在平衡: ,加入少量盐酸后,溶液浅绿色会加深 SO2有漂白性,将SO2通入石蕊试液中,溶液将先变红后褪色 Fe2(SO4)3溶液显酸性,NaClO溶液显碱性,两种溶液混合后会产生红褐色沉淀
,加入少量盐酸后,溶液浅绿色会加深 SO2有漂白性,将SO2通入石蕊试液中,溶液将先变红后褪色 Fe2(SO4)3溶液显酸性,NaClO溶液显碱性,两种溶液混合后会产生红褐色沉淀
Fe3O4溶于足量稀HNO3:Fe3O4+8H+=Fe2++2Fe3++4H2O 等物质的量的MgCl2、Ba(OH)2 和 HC1 溶液混合:Mg2++2OH-= Mg(OH)2↓ 将过量的SO2通入Ca(ClO)2溶液中: SO2+ClO-+H2O =HClO+ HSO3- 将0.2 mol·L-1的NH4Al(SO4)2溶液与0.3 mol·L-1的Ba(OH)2溶液等体积混合: 2Al3++3SO +3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓
+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓
NaHCO3溶液中加入少量的石灰水 HCO3-+ Ca2+ + OH-=CaCO3↓+H.2O. 向氯化铁溶液中通入硫化氢气体 3Fe3+ +H.2S = 2Fe2+ + FeS↓+2H+ 氯化铝溶液中加入过量氨水 Al3+ + 4 OH- = AlO2-+ 2H2O. 氨水中通入过量SO2 NH3·H2O. + SO2 = HSO3- + NH4+
白色沉淀是CuI2,棕色溶液含有I2 滴加KI溶液时,转移2mol e- 时生成1mol白色沉淀 通入SO2时,SO2与I.—反应,I.—作还原剂 上述实验条件下,物质的氧化性:Cu2+>I2>SO2
氧化性Cr2O >Fe3+>SO2 Cr2O
>Fe3+>SO2 Cr2O 能将Na2SO3氧化成Na2SO4 若33.6LSO2(标准状况)参加反应,则最终消耗K2Cr2O7 0.5mol 反应中Fe2(SO4)3既是氧化剂,又是还原剂
能将Na2SO3氧化成Na2SO4 若33.6LSO2(标准状况)参加反应,则最终消耗K2Cr2O7 0.5mol 反应中Fe2(SO4)3既是氧化剂,又是还原剂
硫粉在过量的纯氧中燃烧可以生成大量的SO2 可以用品红溶液鉴别SO2和CO2 SO2能使品红溶液、酸性KMnO4溶液褪色,但褪色原理不同 少量SO2通过CaCl2的溶液能生成白色沉淀
浓度和体积相同的FeBr2、FeI2溶液中,分别通入少量氯气后都首先发生置换反应 XCl3的溶液能与铜片发生反应,则铜的金属性一定比X.强 非金属X.能将Fe氧化到+3价,但非金属Y.不能,则Y.的氧化性一定比X.强 Cl2和SO2等体积充分混合后,通入品红溶液,溶液颜色没有明显变化
①中红色褪去的原因是KMnO4将SCN-氧化,使Fe(SCN)3消失 ②中红色褪色的原因是SO2将Fe3+还原为Fe2+ ②中红色褪色的原因是SO2将SCN-还原 SCN-在适当条件下可失去电子被氧化剂氧化为(SCN)2
B.中蓝色溶液褪色可以证明还原性: I->SO2 实验完成后,检脸A.中是否含有Fe2+,可用酸性KMnO4溶液 实验完成后,向A.中加入用稀盐酸酸化的BaCl2溶液,产生白色沉淀 装置C.的作用是吸收SO2尾气,发生的反应是氧化还原反应

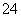 +3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓
+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓
 ,加入少量盐酸后,溶液浅绿色会加深 SO2有漂白性,将SO2通入石蕊试液中,溶液将先变红后褪色 Fe2(SO4)3溶液显酸性,NaClO溶液显碱性,两种溶液混合后会产生红褐色沉淀
,加入少量盐酸后,溶液浅绿色会加深 SO2有漂白性,将SO2通入石蕊试液中,溶液将先变红后褪色 Fe2(SO4)3溶液显酸性,NaClO溶液显碱性,两种溶液混合后会产生红褐色沉淀
 +3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓
+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓
 >Fe3+>SO2 Cr2O
>Fe3+>SO2 Cr2O 能将Na2SO3氧化成Na2SO4 若33.6LSO2(标准状况)参加反应,则最终消耗K2Cr2O7 0.5mol 反应中Fe2(SO4)3既是氧化剂,又是还原剂
能将Na2SO3氧化成Na2SO4 若33.6LSO2(标准状况)参加反应,则最终消耗K2Cr2O7 0.5mol 反应中Fe2(SO4)3既是氧化剂,又是还原剂