你可能感兴趣的试题
2H2+O2 点燃 2H2O 2NaHCO3  Na2CO3+H2O +CO2↑ CuO+CO
Na2CO3+H2O +CO2↑ CuO+CO  Cu + CO2 Zn +H2SO4 = ZnSO4 + H2↑
Cu + CO2 Zn +H2SO4 = ZnSO4 + H2↑
Fe3O4溶于足量稀HNO3:Fe3O4+8H+=Fe2++2Fe3++4H2O 等物质的量的MgCl2、Ba(OH)2 和 HC1 溶液混合:Mg2++2OH-= Mg(OH)2↓ 将过量的SO2通入Ca(ClO)2溶液中: SO2+ClO-+H2O =HClO+ HSO3- 将0.2 mol·L-1的NH4Al(SO4)2溶液与0.3 mol·L-1的Ba(OH)2溶液等体积混合: 2Al3++3SO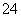 +3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓
+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓
H2 SO4(过量)、HCl、AgNO3 HCl(过量)、Mg SO4、KOH HCl(过量)、KOH、Cu SO4 KNO3 (过量)、NaCl、BaCO3
Fe3O4溶于足量稀HNO3:Fe3O4+8H+=Fe2++2Fe3++4H2O 等物质的量的MgCl2、Ba(OH)2 和 HC1 溶液混合:Mg2++2OH-= Mg(OH)2↓ 将过量的SO2通入Ca(ClO)2溶液中: SO2+ClO-+H2O =HClO+ HSO3- 将0.2 mol·L-1的NH4Al(SO4)2溶液与0.3 mol·L-1的Ba(OH)2溶液等体积混合: 2Al3++3SO +3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓
+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓
1 molZn的能量高于1 molH2的能量 反应物Zn和H2SO4的总能量高于产物 ZnSO4和H2的总能量 如果Zn足量,反应速率会经历由慢到快到慢的过程 用锌粉代替锌粒,速率会加快
选用两种试剂可实现实验目的 ZnSO4溶液中加人Cu不能探究金属活动性强弱 最多只能设计一种实验方案 根据 Zn和Cu的硬度能判断金属活动性强弱
HClO4 H2 SO4 H3 PO4 HClO4 HClO3 HClO2 HC1O HBrO4 HIO4 H2 SO4 H2 SO3 H2 CO3
C.+2CuO 2Cu+CO2↑ 2Fe+3H2SO4===Fe2(SO4)3+3H2↑ 4Fe+3O2== = = 2Fe2O.3 ZnCl2+Na2SO4===ZnSO4↓+2NaCl
2Cu+CO2↑ 2Fe+3H2SO4===Fe2(SO4)3+3H2↑ 4Fe+3O2== = = 2Fe2O.3 ZnCl2+Na2SO4===ZnSO4↓+2NaCl
、ZnSO4、H2SO4 FeSO4、H2SO4 ZnSO4、CuSO4 ZnSO4、FeSO4
选用两种试剂可实现实验目的 ZnSO4溶液中加人Cu不能探究金属活动性强弱 最多只能设计一种实验方案 根据 Zn和Cu的硬度能判断金属活动性强弱
物质B 是锌 物质D 是稀盐酸 溶液A 和固体C 中都含有铜、锌两种元素 过程Ⅱ、Ⅲ中的分离操作是过滤
向明矾溶液中加入等物质的量的Ba(OH)2溶液 Al3++2SO42-+2Ba2++4OH-=AlO2-+2BaSO4↓+2H2O. 向Fe2(SO4)3溶液中通入足量的H2S. Fe3++H2S=Fe2++S↓+2H+ 向硝酸银溶液中滴加过量氨水 Ag++2NH3·H2O=[Ag(NH3)2]++2H2O. 含等物质的量的硫酸氢铵与氢氧化钠两种溶液混合: NH4++HSO4-+2OH-=SO42-+NH3↑+2H2O.
KCl K2SO4 适量硝酸钡溶液,过滤、蒸发 NaCl CaCl2 适量碳酸钠溶液,过滤、蒸发 Cu CuO 过量稀盐酸,过滤、洗涤、干燥 ZnSO4 FeSO4 过量锌粉,过滤、洗涤、干燥
Ag、FeSO4溶液、CuSO4溶液 Fe、Cu、稀H2SO4溶液 Fe、Cu、ZnSO4 Fe、Cu、AgNO3溶液
Cu、Ag、AgNO3溶液 Zn、Cu、稀H2SO4 Fe、Zn、ZnSO4溶液 Fe、C.Fe2(SO4)3溶液

 Na2CO3+H2O +CO2↑ CuO+CO
Na2CO3+H2O +CO2↑ CuO+CO  Cu + CO2 Zn +H2SO4 = ZnSO4 + H2↑
Cu + CO2 Zn +H2SO4 = ZnSO4 + H2↑
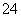 +3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓
+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓
 +3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓
+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓

 2Cu+CO2↑ 2Fe+3H2SO4===Fe2(SO4)3+3H2↑ 4Fe+3O2== = = 2Fe2O.3 ZnCl2+Na2SO4===ZnSO4↓+2NaCl
2Cu+CO2↑ 2Fe+3H2SO4===Fe2(SO4)3+3H2↑ 4Fe+3O2== = = 2Fe2O.3 ZnCl2+Na2SO4===ZnSO4↓+2NaCl