你可能感兴趣的试题
由pH=3的HA与pH=11的NaOH溶液等体积混合,溶液中c(Na+)>c(Ac—)>c(OH—)>c(H+) 0.1mol·L-1HA溶液与0.05mol·L-1NaOH溶液等体积混合后所得溶液中, 2c(H+)+c(HA)=c(A-)+c(OH-) 该溶液中由水电离出的c(H+)=1×10-11 mol·L-1 浓度均为0.1mol/L的HA和NaA溶液等体积混合后,若溶液呈酸性,则 c(A-)>c(HA)>c(Na+)>c(H+)>c(OH-)
Ka(HA)=1×10-6 mol•L-1 b 点时,c(B+)=c(A-)=c(H+)=c(OH-) c 点时, 随温度升高而减小 a→c 过程中水的电离程度始终增大
随温度升高而减小 a→c 过程中水的电离程度始终增大
HA为弱酸,BOH为强碱 a点时,溶液中粒子浓度存在关系: c(B.+) > c(Cl-) > c(OH-) > c(BOH) c、d两点溶液混合后微粒之间存在关系: c(H+) = c(OH-) + c(BOH) b点时两种溶液中水的电离程度相同,且V.=20
①溶液中:c(A-)>c(Na+)>c(OH-)>c(H+) ①溶液中:c(HA)+c(A-)=0.1mol/L 常温下,0.1mol/LHA溶液的pH=1 0.1mol/LHA溶液中:c(HA)>c(A-)
浓度均为0.1 mol/L的氨水与盐酸等体积混合后的溶液中:c(H+)=c(OH-)+c(NH3·H2O) 浓度均为0.1 mol/L的CH3COOH与CH3COONa溶液等体积混合后溶液显酸性,则c(CH3COO-)3COOH) 浓度均为0.1 mol/L的小苏打溶液和氢氧化钠溶液等体积混合: c(Na+)+c(H+)=c(CO32-)+c(OH-)+c(HCO3-) 室温下,用pH=3的HCl溶液滴定10 mL pH=11的氨水,达到滴定终点时用去盐酸的体积为10 mL
由pH=3的HA与pH=11的NaOH溶液等体积混合,溶液中c(Na+)>c(A-)>c(OH-) >c(H+) 该溶液中由水电离出的c(H+)=1×10-11mol·L-1 浓度均为0.1mol·L.-1的HA和NaA溶液等体积混合后,若溶液呈酸性, 则 c(A-)>c(HA)>c(Na+)>c(H+)>c(OH-) 0.1mol·L-1HA溶液与0.05mol·L.-1溶液等体积混合后所得溶液中c(H+)+c(HA)= c(A-)+c(OH-)
该温度下HB的电离平衡常数约为1.11×10-5 溶液中水的电离程度:a=c>b 相同条件下NaA溶液的pH大于NaB溶液的pH 当 时,若同时微热两种溶液(不考虑HA.HB和H2O的挥发),则
时,若同时微热两种溶液(不考虑HA.HB和H2O的挥发),则 减小
减小
Ka(HA)=1×10-6mol/L b点c (B+)=c(A-)=c(OH-)=c(H+) c点时, 随温度升高而减小 a→c过程中水的电离程度始终增大
随温度升高而减小 a→c过程中水的电离程度始终增大
HB的电离平衡常数Ka(HA)>Ka(HB)。下列有关说法正确的是( ) A.等温浓度均为0.1 mol·L-1的HA.HB溶液中,其溶液的pH大小为:pH(HA)>pH(HB) 在0.1mol·L-1的NaA溶液中各离子浓度关系为:c(Na+)>c(A-)>c(OH-)>c(H+) 等体积pH相同的HA.HB溶液,分别加入等浓度的NaOH溶液,恰好完全反应消耗的NaOH溶液体积HA比HB多 等温浓度均为0.1 mol·L-1的NaA.NaB溶液中,其溶液的pH大小为:pH(NaA)>pH(NaB)
pH=12的氨水溶液与pH=2的盐酸溶液等体积混合 浓度均为0.1 mol/L.的硫酸氢铵溶液和氢氧化钠溶液等体积混合
浓度均为0.1 mol/L.的硫酸氢铵溶液和氢氧化钠溶液等体积混合 浓度均为0.1 mol/L.的小苏打溶液和氢氧化钠溶液等体积混合
浓度均为0.1 mol/L.的小苏打溶液和氢氧化钠溶液等体积混合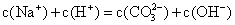 浓度均为0.1 mol/L.的醋酸溶液和氢氧化钠溶液等体积混合
浓度均为0.1 mol/L.的醋酸溶液和氢氧化钠溶液等体积混合 
pH=12的氨水溶液与pH=2的盐酸溶液等体积混合 c(NH4+)>c(Cl-)>c(OH-)>c(H+) 浓度均为0.1mol·L-1的硫酸氢铵溶液与氢氧化钠溶液等体 积混合c(Na+)>c(SO42-)>c(NH4+)>c(H+)>c(OH-) 浓度均为0.1mol·L-1的小苏打溶液与烧碱溶液等体积混合: c(Na+)+c(H+)=2c(CO32-)+c(OH-) 浓度均为0.1mol·L-1的醋酸溶液与氢氧化钠溶液等体积混合 c(Na+)=c(CH3COO-)>c(OH-)=c(H+)
该溶液中:c2(H+)≠c(H+)·c(A-)+Kw 由pH=3的HA溶液与pH=11的NaOH溶液等体积混合,所得溶液中: c(Na+)>c(A-)>c(OH-)>c(H+) 浓度均为0.1 mol·L-1的HA和NaA溶液等体积混合,所得溶液中: c(A-)>c(HA)>c(Na+)>c(OH-)>c(H+) 0.1 mol·L-1 HA溶液与0.05 mol·L-1 NaOH溶液等体积混合,所得溶液中: 2c(H+)+c(HA)===c(A-)+2c(OH-)
M.点溶液中c(A-)等于N.点溶液中c(B-) HA的电离常数约为10-4 浓度均为0.1 mol/L的NaA和HA混合溶液的pH<7 M.、P.两点的溶液分别用等浓度的NaOH溶液中和,消耗的NaOH溶液体积:P>M
HX、HY都是弱酸,且HX的酸性比HY的弱 常温下,由水电离出的c(H+)·c(OH-):a相同温度下,电离常数K.(HX):a>b lg =3,若同时微热两种溶液(不考虑HX、HY和H2O的挥发),则
=3,若同时微热两种溶液(不考虑HX、HY和H2O的挥发),则 减小
减小
该溶液中:2c (H.+)=c(A.﹣)+c(OH﹣) 由pH=3的HA溶液与pH=11的NaOH溶液等体积混合,所得溶液中: c(Na+)>c(A.﹣)>c(OH﹣)>c(H.+) 浓度均为0.1 mol•L﹣1的HA和NaA溶液等体积混合,所得溶液中: c(A.﹣)>c(HA)>c(Na+)>c(OH﹣)>c(H.+) 0.1 mol•L﹣1 HA溶液与0.05 mol•L﹣1 NaOH溶液等体积混合,所得溶液中: 2c(H.+)+c(HA)═c(A.﹣)+2c(OH﹣)
Ka(HA)=1×10-6mol/L b点c (B+)=c(A-)=c(OH-)=c(H+) c点时, 随温度升高而减小 a→c过程中水的电离程度始终增大
随温度升高而减小 a→c过程中水的电离程度始终增大
稀释前两溶液的Ka:MOH溶液>ROH溶液 ROH的电离程度:b点小于a点 两溶液在稀释过程中,c(H+)均逐渐减少 当 时,若两溶液同时升高温度,则
时,若两溶液同时升高温度,则 增大
增大
9~11之间;0.1 9~11之间;0.2 12~13之间;0.2 13;0.1
该溶液中由水电离出的c(H.+)=1×10-3 mol・L-1 由pH=3的HA与pH=11的NaOH溶液等体积混合,溶液中c(Na+)>c(A.-)>c(OH-)>c(H.+) 浓度均为0.1mol/L的HA和NaA溶液等体积混合后,若溶液呈酸性,则c(A.-)>c(HA)>c(Na+)>c(H.+)>c(OH-) 0.1mol・L-1HA溶液与0.05mol・L-1NaOH溶液等体积混合后所得溶液中2c(H.+)+c(HA)=c(A.-)+2c(OH-)

 随温度升高而减小 a→c 过程中水的电离程度始终增大
随温度升高而减小 a→c 过程中水的电离程度始终增大
 时,若同时微热两种溶液(不考虑HA.HB和H2O的挥发),则
时,若同时微热两种溶液(不考虑HA.HB和H2O的挥发),则 减小
减小
 随温度升高而减小 a→c过程中水的电离程度始终增大
随温度升高而减小 a→c过程中水的电离程度始终增大
 浓度均为0.1 mol/L.的硫酸氢铵溶液和氢氧化钠溶液等体积混合
浓度均为0.1 mol/L.的硫酸氢铵溶液和氢氧化钠溶液等体积混合 浓度均为0.1 mol/L.的小苏打溶液和氢氧化钠溶液等体积混合
浓度均为0.1 mol/L.的小苏打溶液和氢氧化钠溶液等体积混合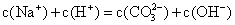 浓度均为0.1 mol/L.的醋酸溶液和氢氧化钠溶液等体积混合
浓度均为0.1 mol/L.的醋酸溶液和氢氧化钠溶液等体积混合 
 =3,若同时微热两种溶液(不考虑HX、HY和H2O的挥发),则
=3,若同时微热两种溶液(不考虑HX、HY和H2O的挥发),则 减小
减小
 随温度升高而减小 a→c过程中水的电离程度始终增大
随温度升高而减小 a→c过程中水的电离程度始终增大
 时,若两溶液同时升高温度,则
时,若两溶液同时升高温度,则 增大
增大