你可能感兴趣的试题
和2 mol 放入2L.密闭容器中发生反应2A(g) + B(g) 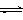 2C(g) ΔH.<0。4 s后反应达到平衡状态,此时测得 的浓度为0.6 mol/L。下列说法正确的是A.4 s内,υB.=0.075 mol/(L ·s)B.当c(A.)︰c(B.)︰c(C.)=2︰1︰2 时,该反应即达到平衡状态C.达到平衡状态后,若只升高温度,则C.的物质的量浓度增大 达到平衡状态后,若温度不变,缩小容器的体积,则A.的转化率降低
2C(g) ΔH.<0。4 s后反应达到平衡状态,此时测得 的浓度为0.6 mol/L。下列说法正确的是A.4 s内,υB.=0.075 mol/(L ·s)B.当c(A.)︰c(B.)︰c(C.)=2︰1︰2 时,该反应即达到平衡状态C.达到平衡状态后,若只升高温度,则C.的物质的量浓度增大 达到平衡状态后,若温度不变,缩小容器的体积,则A.的转化率降低
(g)达到平衡后,下列说法正确的是 A. 测得容器内压强增大p%,A.的转化率也是p% 恒容容器内平衡后再充入A.(g),此平衡逆向移动 恒容容器内平衡后再充入等量的A.(g),达到新平衡后,容器内压强p’为原平衡容器压强p的2倍 恒压容器内平衡后再充入Ar(g),A.的转化率不变
刚充入时,反应速率V (正)减小,V. (逆)增大 达到新平衡时,容器内气体的平均相对分子质量增大 达到新平衡时,容器内气体的压强是原来的两倍 达到新平衡时,容器内气体的百分组成和原来相同
若不断增加A.的质量,可使反应放出热量的数值达到2︱ΔH︱ 4 s内,υB.=0.075 mol/(L ·s) 达到平衡状态后,若只升高温度,则C.的物质的量浓度增大 达到平衡状态后,若温度不变,缩小容器的体积,则A.的转化率降低
平衡向正反应方向移动,达到新平衡时容器内的压强一定减小
平衡向逆反应方向移动,容器内的压强一定不增大
平衡不移动,只增大了容器内的压强
平衡向正反应方向移动,容器内的压强不一定增大
和2 mol 放入2L.密闭容器中发生反应2A(g) + B(g)  2C(g) ΔH.<0。 4 s后反应达到平衡状态,此时测得 的浓度为0.6 mol/L。下列说法正确的是 A.4 s内,υB.=0.075 mol/(L ·s) B.当cA.︰cB.︰cC.=2︰1︰2 时,该反应即达到平衡状态 C.达到平衡状态后,若只升高温度,则C.的物质的量浓度增大 达到平衡状态后,若温度不变,缩小容器的体积,则A.的转化率降低
2C(g) ΔH.<0。 4 s后反应达到平衡状态,此时测得 的浓度为0.6 mol/L。下列说法正确的是 A.4 s内,υB.=0.075 mol/(L ·s) B.当cA.︰cB.︰cC.=2︰1︰2 时,该反应即达到平衡状态 C.达到平衡状态后,若只升高温度,则C.的物质的量浓度增大 达到平衡状态后,若温度不变,缩小容器的体积,则A.的转化率降低
和2 mol 放入2L.密闭容器中发生反应2A(g) + B(g)  2C(g) ΔH.<0。4 s后反应达到平衡状态,此时测得 的浓度为0.6 mol/L。下列说法正确的是 A.4 s内,υB.=0.075 mol/(L ·s) B.当cA.︰cB.︰cC.=2︰1︰2 时,该反应即达到平衡状态 C.达到平衡状态后,若只升高温度,则C.的物质的量浓度增大 达到平衡状态后,若温度不变,缩小容器的体积,则A.的转化率降低
2C(g) ΔH.<0。4 s后反应达到平衡状态,此时测得 的浓度为0.6 mol/L。下列说法正确的是 A.4 s内,υB.=0.075 mol/(L ·s) B.当cA.︰cB.︰cC.=2︰1︰2 时,该反应即达到平衡状态 C.达到平衡状态后,若只升高温度,则C.的物质的量浓度增大 达到平衡状态后,若温度不变,缩小容器的体积,则A.的转化率降低
前4 s以N2O4的浓度变化表示的平均反应速率为0.01 mol·L-1·s-1 4 s时容器内的压强为开始时的1.2倍 平衡时容器内含0.4 mol N2O4 平衡时容器内含0.8 mol NO2
向正反应方向移动 向逆反应方向移动 不移动 先向正反应方向移动,后向逆反应方向移动
和2 mol 放入2L.密闭容器中发生反应2A(g) + B(g) 2C(g) ΔH.<0。4 s后反应达到平衡状态,此时测得 的浓度为0.6 mol/L。下列说法正确的是( ) A.4 s内,υB.=0.075 mol/(L ·s) B.当cA.︰cB.︰cC.=2︰1︰2 时,该反应即达到平衡状态 C.达到平衡状态后,若只升高温度,则C.的物质的量浓度增大 达到平衡状态后,若温度不变,缩小容器的体积,则A.的转化率降低
2C(g) ΔH.<0。4 s后反应达到平衡状态,此时测得 的浓度为0.6 mol/L。下列说法正确的是( ) A.4 s内,υB.=0.075 mol/(L ·s) B.当cA.︰cB.︰cC.=2︰1︰2 时,该反应即达到平衡状态 C.达到平衡状态后,若只升高温度,则C.的物质的量浓度增大 达到平衡状态后,若温度不变,缩小容器的体积,则A.的转化率降低
平衡时NO2体积分数:甲<乙 达到平衡所需时间,甲与乙相等 该反应的平衡常数表达式K.=c(N2O4)/c(NO2) 若两容器内气体的压强保持不变,均说明反应已达到平衡状态
平衡时,N2O4的转化率为60% 平衡时,体系内NO2为0.12mol·L-1 其它条件不变,平衡后再往该密闭容器中通入0.5molN2O4气体,重新达到平衡时N2O4的体积百分数减少 其它条件不变,平衡后再往该密闭容器中通入1molN2O4气体,重新达到平衡时该反应平衡常数不变
和2 mol 放入2L.密闭容器中发生反应2A(g) + B(g) 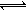 2C(g) ΔH.<0。4 s后反应达到平衡状态,此时测得 的浓度为0.6 mol/L。下列说法正确的是 A.4 s内,υB.=0.075 mol/(L ·s)B.当cA.︰cB.︰cC.=2︰1︰2 时,该反应达到平衡状态 C.达到平衡状态后,若只升高温度,则C.的物质的量浓度增大 达到平衡状态后,若温度不变,缩小容器的体积,则A.的转化率降低
2C(g) ΔH.<0。4 s后反应达到平衡状态,此时测得 的浓度为0.6 mol/L。下列说法正确的是 A.4 s内,υB.=0.075 mol/(L ·s)B.当cA.︰cB.︰cC.=2︰1︰2 时,该反应达到平衡状态 C.达到平衡状态后,若只升高温度,则C.的物质的量浓度增大 达到平衡状态后,若温度不变,缩小容器的体积,则A.的转化率降低
达到化学平衡状态时,容器中将生成2molNH3 t分钟后,只要条件不变,容器内各气体的浓度就不再变化 达到化学平衡状态时,v(N2)=v(H2)=v(NH3) 达到化学平衡状态时,正反应和逆反应的速率相等,且均等于0

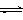 2C(g) ΔH.<0。4 s后反应达到平衡状态,此时测得 的浓度为0.6 mol/L。下列说法正确的是A.4 s内,υB.=0.075 mol/(L ·s)B.当c(A.)︰c(B.)︰c(C.)=2︰1︰2 时,该反应即达到平衡状态C.达到平衡状态后,若只升高温度,则C.的物质的量浓度增大 达到平衡状态后,若温度不变,缩小容器的体积,则A.的转化率降低
2C(g) ΔH.<0。4 s后反应达到平衡状态,此时测得 的浓度为0.6 mol/L。下列说法正确的是A.4 s内,υB.=0.075 mol/(L ·s)B.当c(A.)︰c(B.)︰c(C.)=2︰1︰2 时,该反应即达到平衡状态C.达到平衡状态后,若只升高温度,则C.的物质的量浓度增大 达到平衡状态后,若温度不变,缩小容器的体积,则A.的转化率降低
 2C(g) ΔH.<0。 4 s后反应达到平衡状态,此时测得 的浓度为0.6 mol/L。下列说法正确的是 A.4 s内,υB.=0.075 mol/(L ·s) B.当cA.︰cB.︰cC.=2︰1︰2 时,该反应即达到平衡状态 C.达到平衡状态后,若只升高温度,则C.的物质的量浓度增大 达到平衡状态后,若温度不变,缩小容器的体积,则A.的转化率降低
2C(g) ΔH.<0。 4 s后反应达到平衡状态,此时测得 的浓度为0.6 mol/L。下列说法正确的是 A.4 s内,υB.=0.075 mol/(L ·s) B.当cA.︰cB.︰cC.=2︰1︰2 时,该反应即达到平衡状态 C.达到平衡状态后,若只升高温度,则C.的物质的量浓度增大 达到平衡状态后,若温度不变,缩小容器的体积,则A.的转化率降低
 2C(g) ΔH.<0。4 s后反应达到平衡状态,此时测得 的浓度为0.6 mol/L。下列说法正确的是 A.4 s内,υB.=0.075 mol/(L ·s) B.当cA.︰cB.︰cC.=2︰1︰2 时,该反应即达到平衡状态 C.达到平衡状态后,若只升高温度,则C.的物质的量浓度增大 达到平衡状态后,若温度不变,缩小容器的体积,则A.的转化率降低
2C(g) ΔH.<0。4 s后反应达到平衡状态,此时测得 的浓度为0.6 mol/L。下列说法正确的是 A.4 s内,υB.=0.075 mol/(L ·s) B.当cA.︰cB.︰cC.=2︰1︰2 时,该反应即达到平衡状态 C.达到平衡状态后,若只升高温度,则C.的物质的量浓度增大 达到平衡状态后,若温度不变,缩小容器的体积,则A.的转化率降低
 2C(g) ΔH.<0。4 s后反应达到平衡状态,此时测得 的浓度为0.6 mol/L。下列说法正确的是( ) A.4 s内,υB.=0.075 mol/(L ·s) B.当cA.︰cB.︰cC.=2︰1︰2 时,该反应即达到平衡状态 C.达到平衡状态后,若只升高温度,则C.的物质的量浓度增大 达到平衡状态后,若温度不变,缩小容器的体积,则A.的转化率降低
2C(g) ΔH.<0。4 s后反应达到平衡状态,此时测得 的浓度为0.6 mol/L。下列说法正确的是( ) A.4 s内,υB.=0.075 mol/(L ·s) B.当cA.︰cB.︰cC.=2︰1︰2 时,该反应即达到平衡状态 C.达到平衡状态后,若只升高温度,则C.的物质的量浓度增大 达到平衡状态后,若温度不变,缩小容器的体积,则A.的转化率降低
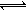 2C(g) ΔH.<0。4 s后反应达到平衡状态,此时测得 的浓度为0.6 mol/L。下列说法正确的是 A.4 s内,υB.=0.075 mol/(L ·s)B.当cA.︰cB.︰cC.=2︰1︰2 时,该反应达到平衡状态 C.达到平衡状态后,若只升高温度,则C.的物质的量浓度增大 达到平衡状态后,若温度不变,缩小容器的体积,则A.的转化率降低
2C(g) ΔH.<0。4 s后反应达到平衡状态,此时测得 的浓度为0.6 mol/L。下列说法正确的是 A.4 s内,υB.=0.075 mol/(L ·s)B.当cA.︰cB.︰cC.=2︰1︰2 时,该反应达到平衡状态 C.达到平衡状态后,若只升高温度,则C.的物质的量浓度增大 达到平衡状态后,若温度不变,缩小容器的体积,则A.的转化率降低