你可能感兴趣的试题
该反应为吸热反应 CO(g)和H2O(g)具有的总能量大于CO2(g)和H2(g)具有的总能量 该反应不需要加热就能进行 1 mol CO2(g)和1 mol H2(g)反应生成1 mol CO(g)和1 mol H2O(g)放出41 kJ热量
每生成2分子AB吸收bkJ热量 断裂1molA—A.和1molB—B.键,放出akJ能量 该反应中反应物的总能量高于生成物的总能量 该反应热△H=+(a-b)kJ/mol
H2O(g)═H2O(l)△H=﹣44kJ/mol 2HI(g)═H2(g)+I2(g)△H=+14.9kJ/mol 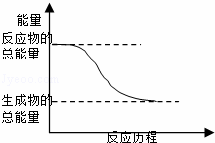 能量变化如图所示的化学反应 形成化学键时放出能量的化学反应
能量变化如图所示的化学反应 形成化学键时放出能量的化学反应
在一定条件下,某可逆反应的△H=+100kJ•mol-1,则该反应正反应活化能比逆反应活化能大100kJ•mol-1 图中A.B.曲线可分别表示反应: CH2=CH2(g)+H2(g)→CH3CH3(g)△H.>0 未使用和使用催化剂时,反应过程中的能量变化 同温同压下,反应H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件 下的△H.不同 己知2C(s)+2O2(g)=2CO2(g)△H1;2C(s)+O2(g)=2CO(g)△H2.则△H1>△H2
能量变化如图所示的化学反应 H2O(g)=H2O(l);△H.=-44.0 kJ/mol 形成化学键时共放出能量862 kJ的化学反应 2HI(g)=H2(g)+I2(g);△H.=+14.9 kJ/mol
H2O(g)=H2O(l);△H.=-44.0 kJ/mol 形成化学键时共放出能量862 kJ的化学反应 2HI(g)=H2(g)+I2(g);△H.=+14.9 kJ/mol
2A(g)+B(g)=2C(g)
ΔH=a(a>0)
2A(g)+B(g)=2C(g) ΔH=a(a<0)
2A+B=2C ΔH=a(a<0)
2C=2A+B ΔH=a(a>0)
H2O(g)===H2O(l) ΔH.=-44.0 kJ/mol 2HI(g) H2(g)+I2(g) ΔH.=+14.9 kJ/mol 形成化学键时共放出能量862 kJ的化学反应 能量变化如图所示的化学反应
H2(g)+I2(g) ΔH.=+14.9 kJ/mol 形成化学键时共放出能量862 kJ的化学反应 能量变化如图所示的化学反应 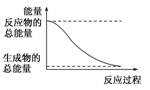
2A(g)+ (g)===2C(g) ΔH.=a(a>0) B.2A(g)+B.(g)===2C(g) ΔH.=a(a<0) 2A+B===2C ΔH.=a(a<0) 2C===2A+B. ΔH.=a(a>0)
在一定条件下,某可逆反应的△H=+100kJ•mol-1,则该反应正反应活化能比逆反应活化能大100kJ•mol-1 图中A.B.曲线可分别表示反应: CH2=CH2(g)+H2(g)→CH3CH3(g)△H.>0 未使用和使用催化剂时,反应过程中的能量变化 同温同压下,反应H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件 下的△H.不同 己知2C(s)+2O2(g)=2CO2(g)△H1;2C(s)+O2(g)=2CO(g)△H2.则△H1>△H2
该反应热△H= -(a-b) kJ•mol-1 每生成2mol AB(g)吸收b kJ 该反应中反应物的总能量高于生成物的总能量 该反应中反应物的总键能大于生成物的总键能
12gC.(s)与一定量O2(g)反应生成14g CO(g)放出的热量为110.5kJ
该反应的热化学方程式是2C(s)+O2(g)═2CO(g)△H=-221kJ
2molC.(s)与足量O2(g)反应生成CO2(g),放出的热量大于221kJ
该反应的反应热等于CO分子中化学键形成时所释放的总能量与O2分子中化学键断裂时所吸收的总能量的差
2A(g)+B(g) =2C(g) △H<0 2A(g)+B(g) =2C(g) △H>0 2A+B=2C △H<0 2C=2A+B △H<0
1 mol N2(g)和1 mol O2(g)反应放出的能量为180 kJ 1 mol N2(g)和1 mol O2(g)具有的总能量小于2 mol NO(g)具有的总能量 通常情况下,N2(g)和O2(g)混合能直接生成NO NO是一种酸性氧化物,能与NaOH溶液反应生成盐和水
H2O(g)===H2O(l)ΔH.=-44.0 kJ/mol 2HI(g)===H2(g)+I2(g) ΔH.=+14.9 kJ/mol 形成化学键时共放出能量862 kJ的化学反应 能量变化如图所示的化学反应 
a b c d 
2A+B ==2C;△H2C==2A+B;△H<0 2A(g)+B(g)==2C(g);△H>0 2A(g)+B(g)==2C(g);△H<0 
2A+B = 2C △H.<0 2C(g) = 2A(g)+B(g) △H.<0 2A(g)+B(g) = 2C(g) △H.>0 2A(g)+B(g) = 2C(g) △H.<0 

 能量变化如图所示的化学反应 形成化学键时放出能量的化学反应
能量变化如图所示的化学反应 形成化学键时放出能量的化学反应
 H2O(g)=H2O(l);△H.=-44.0 kJ/mol 形成化学键时共放出能量862 kJ的化学反应 2HI(g)=H2(g)+I2(g);△H.=+14.9 kJ/mol
H2O(g)=H2O(l);△H.=-44.0 kJ/mol 形成化学键时共放出能量862 kJ的化学反应 2HI(g)=H2(g)+I2(g);△H.=+14.9 kJ/mol

 H2(g)+I2(g) ΔH.=+14.9 kJ/mol 形成化学键时共放出能量862 kJ的化学反应 能量变化如图所示的化学反应
H2(g)+I2(g) ΔH.=+14.9 kJ/mol 形成化学键时共放出能量862 kJ的化学反应 能量变化如图所示的化学反应 


