你可能感兴趣的试题
两种溶液的pH:盐酸大于醋酸
用相同浓度的NaOH溶液分别与等体积的盐酸和醋酸溶液恰好反应完全,盐酸消耗的NaOH溶液体积多
向醋酸中加入等物质的量的NaOH,溶液呈碱性,且溶液中
两种溶液中水电离出的氢离子:盐酸大于醋酸
氢离子浓度相等 H2SO4和HAc的浓度相等 H2SO4的浓度为HAc浓度的1/2 H2SO4和HAc的电离度相等
加少量氯化铵晶体,两溶液的pH均减小 温度下降10℃,两溶液的pH均不变 分别加水稀释10倍,两溶液的pH仍相等 用同浓度盐酸中和,消耗盐酸体积相同
浓度均为0.1 mol·L-1的 HCOONa和NH4Cl 溶液中阳离子的物质的量浓度之和: 前者小于后者 用相同浓度的NaOH溶液分别滴定等体积pH均为3的HCOOH和CH3COOH溶液至终点,消耗NaOH溶液的体积相等 0.2 mol·L-1 HCOOH 与 0.1 mol·L-1 NaOH 等体积混合后的溶液中: c(HCOO-) + c(OH-) = c(HCOOH) + c(H+) 0.2 mol·L-1 CH3COONa 与 0.1 mol·L-1盐酸等体积混合后的溶液中(pH<7): c(CH3COO-) > c(Cl- ) > c(CH3COOH) > c(H+)
HX为弱酸 M.点c(HX)-c(X-)﹥c(OH-)-c(H+) 将P.点和N.点的溶液混合,呈酸性 向N.点的溶液中通入HCl至pH=7:c(Na+) ﹥c(HX)=c(Cl-) >c(X-)
HA为弱酸,BOH为强碱 a点时,溶液中粒子浓度存在关系: c(B.+) > c(Cl-) > c(OH-) > c(BOH) c、d两点溶液混合后微粒之间存在关系: c(H+) = c(OH-) + c(BOH) b点时两种溶液中水的电离程度相同,且V.=20
浓度均为0.1 mol/L的氨水与盐酸等体积混合后的溶液中:c(H+)=c(OH-)+c(NH3·H2O) 浓度均为0.1 mol/L的CH3COOH与CH3COONa溶液等体积混合后溶液显酸性,则c(CH3COO-)3COOH) 浓度均为0.1 mol/L的小苏打溶液和氢氧化钠溶液等体积混合: c(Na+)+c(H+)=c(CO32-)+c(OH-)+c(HCO3-) 室温下,用pH=3的HCl溶液滴定10 mL pH=11的氨水,达到滴定终点时用去盐酸的体积为10 mL
酸式滴定管用蒸馏水洗净后,直接加入已知浓度的盐酸 锥形瓶用蒸馏水洗净后,润洗后,加入一定体积的未知浓度的NaOH溶液 滴定时,没有逐出滴定管下口的气泡 滴定时,眼睛注视锥形瓶内溶液颜色的变化
滴定前,没有逐出滴定管下口的气泡 用甲基橙作指示剂,指示剂刚变色,就停止滴定 酸式滴定管用蒸馏水洗净后,直接加入己知浓度的盐酸 锥形瓶用蒸馏水洗净后,直接加入一定体积的未知浓度的NaOH溶液
加水稀释,两溶液中的氢离子数目都不变 用等浓度的NaOH溶液中和,盐酸比甲酸消耗的碱液少 跟等质量铝粉反应,盐酸比甲酸的起始反应速率快 跟过量的锌粒反应,盐酸比甲酸产生氢气的量多
在相同温度下,同浓度的三种酸溶液的导电能力顺序:HZ>HY>HX 用NaOH溶液滴定HY,当V.(NaOH) = 10mL时溶液中c(Y-)>c(Na+)>c(H+)>c(OH-) 用NaOH溶液滴定HX,当V.(NaOH)=10mL时溶液中2c(Na+)=c(X-)+c(HX) 当三种酸均滴定至pH=7时,HZ所用NaOH溶液体积最小
图1可以表示用NaOH溶液滴定1 mol·L-1的稀盐酸 图1可以表示用NaOH溶液滴定1 mol·L-1的稀醋酸 图2可以表示在MgCl2中逐滴加入相同浓度相同体积的NaOH溶液 图2可以表示在稀盐酸中逐滴加入相同浓度相同体积的NaOH溶液 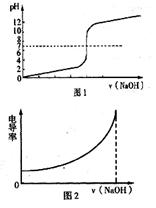
HB各1 mL,分别加水稀释到1000 mL,其pH与溶液体积(V.)的关系如图所示,下列说法不正确的是  A.同浓度、同体积的HA.HB溶液分别加入过量的锌粒,产生的氢气体积后者大 物质的量浓度HA若1体积相同pH均为1的HA.HB溶液分别滴加同浓度的NaOH溶液至中性,前者消耗的NaOH少
A.同浓度、同体积的HA.HB溶液分别加入过量的锌粒,产生的氢气体积后者大 物质的量浓度HA若1体积相同pH均为1的HA.HB溶液分别滴加同浓度的NaOH溶液至中性,前者消耗的NaOH少
两种溶液中的c(Na+)相等 两溶液中由水电离出的c(OH-)之比为10-9/10-5 分别加水稀释到100mL时,两种溶液的pH依然相等 分别与同浓度的盐酸反应,恰好反应时消耗的盐酸体积相等
浓度均为0.1 mol·L-1的 HCOONa和NH4Cl 溶液中阳离子的物质的量浓度之和:前者小于后者 用相同浓度的NaOH溶液分别滴定等体积pH均为3的HCOOH和CH3COOH溶液至终点,消耗NaOH溶液的体积相等 0.2 mol·L-1 HCOOH 与 0.1 mol·L-1 NaOH 等体积混合后的溶液中: c(HCOO-) + c(OH-) = c(HCOOH) + c(H+) 0.10 mol·L-1CH3COONa溶液中通入HCl至溶液呈中性:c(Na+)>c(Cl-)=c(CH3COOH)



 A.同浓度、同体积的HA.HB溶液分别加入过量的锌粒,产生的氢气体积后者大 物质的量浓度HA
A.同浓度、同体积的HA.HB溶液分别加入过量的锌粒,产生的氢气体积后者大 物质的量浓度HA