你可能感兴趣的试题
1molC10H20分子中,含29×6.02×1023个共用电子对 10mL18.4mol·L-1的浓硫酸与90mL蒸馏水混合,所得溶液中c(H+)=3.68 mol·L-1 25℃时,在pH=4的HCl溶液与pH=10的Na2CO3溶液中,由于HCl抑制水的电离、Na2CO3促进水的电离,溶液中c(H+)后者大于前者 在25mL0.1mol·L-1NaOH溶液中,滴入0.1 mol·L-1的CH3COOH溶液至混合溶液pH=7时,则滴加CH3COOH溶液的体积大于25mL
在有AgC1沉淀的溶液中滴加过量的氨水:AgC1+2NH3.H20=[Ag(NH3)2]++C1- +2H20 在三氯化铁的溶液中滴加适量的KI溶液: Fe3++21~=Fe2+I2 F2与Na0H溶液反应: F2+40H-= =2F- +02+2H2O 向碳酸钠溶液中滴加氢氧化钡溶液: co2-3+Ba( 0H)2= BaCO3↓++ 20H-
H2A属于强酸  随着V.[NaOH(aq)]的增大而减小 V.[NaOH(aq)]=20 mL时,溶液中存在关系:c(HA-)+c(A2-)+c(H2A.)=0.05 mol·L-1 V.[NaOH(aq)]=20 mL时,溶液中存在关系:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-)
随着V.[NaOH(aq)]的增大而减小 V.[NaOH(aq)]=20 mL时,溶液中存在关系:c(HA-)+c(A2-)+c(H2A.)=0.05 mol·L-1 V.[NaOH(aq)]=20 mL时,溶液中存在关系:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-)
浊液a中存在沉淀溶解平衡:AgCl(s)⇌Ag+(aq)+Cl﹣(aq) 滤液b中不含有Ag+ ③中颜色变化说明AgCl转化为AgI 实验可以证明AgI比AgCl更难溶。
当V(NaOH)=0时,由水电离出的c(H+)=1.0×10-7 当V(NaOH)=20 mL时, c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-) 当V(NaOH)=40 mL时,2c(Na+)=c(SO32-) 当V(NaOH)=40 mL后,继续滴加NaOH溶液,溶液的温度会继续升高
向煮沸的1 molL-1NaOH溶液中滴加FeCl3饱和溶液制备Fe(OH)3胶体 向乙酸乙酯中加入饱和Na2CO3溶液,振荡,分液分离除去乙酸乙酯中少量乙酸 称取19.0 g SnCl2,用100 mL蒸馏水溶解,配制1.0 molL-1SnCl2溶液 用氢氧化铜粉末检测尿糖
根据滴定曲线可得 25℃时 Ka(CH3COOH)≈Kb (NH3·H2O) ≈10-5 当NaOH溶液和盐酸滴加至20.00mL时,曲线Ⅰ和 Ⅱ刚好相交 曲线Ⅱ:滴加溶液到10.00 mL时,溶液中 c(CH3COO-)+ c(OH-) >c(CH3COOH) + c(H+) 在逐滴加入NaOH溶液或盐酸至40.00mL的过程中, 水 的电离程度先增大后减小 Ⅱ.非选择题部分(共49分)
曲线I.中滴加溶液到10 mL时: c(CH3COO-)>c(Na+)>c(H+)>c(OH-) 曲线I.中滴加溶液到25 mL时: c(NH4+)>c(C1-)>c(H+)>c(OH-) 曲线II中滴加溶液在10 mL~25 mL之间存在: c(NH4+)=c(Cl-)>c(OH-)=c(H+) 曲线II中滴加溶液到10mL时:c(CH3COO-)-c(CH3COOH)=2[c(H+)-c(OH-)] 
曲线Ⅰ:滴加溶液到10 mL时:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) 曲线Ⅰ:滴加溶液到20 mL时,c(Cl-)>c(NH )>c(H+)>c(OH-) 曲线Ⅱ:滴加溶液在10 mL~20 mL之间存在:c(NH
)>c(H+)>c(OH-) 曲线Ⅱ:滴加溶液在10 mL~20 mL之间存在:c(NH )=c(Cl-)>c(OH-)=c(H+) 曲线Ⅱ:滴加溶液到10 mL时:c(CH3COO-)-c(CH3COOH)=2c(H+)-c(OH
)=c(Cl-)>c(OH-)=c(H+) 曲线Ⅱ:滴加溶液到10 mL时:c(CH3COO-)-c(CH3COOH)=2c(H+)-c(OH
H2R的一级电离平衡常数Ka1≈4.0 pH=2.5的H2R溶液中:c(HR-)+c(R2-)+c(OH-)=10-2.5 pH=5.5的该溶液中:c(HR-)>c(R2-)>c(H+)>c(OH-) 向pH=7的该溶液中滴加少量稀硫酸,a(HR-)减小
10℃20mL3 molL﹣1的X溶液 20℃30 mL 2 molL﹣1的X溶液 20℃10 mL 4 molL﹣1的X溶液 10℃10 mL 2 molL﹣1的X溶液
曲线Ⅰ,滴加10 mL溶液时:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) 曲线Ⅰ,滴加20 mL溶液时:c(Cl-)=c(NH )>c(H+)=c(OH-) 曲线Ⅱ,所滴加溶液在10~20 mL之间时存在:c(NH
)>c(H+)=c(OH-) 曲线Ⅱ,所滴加溶液在10~20 mL之间时存在:c(NH )=c(Cl-)>c(OH-)=c(H+) 曲线Ⅱ,滴加10 mL溶液时:c(CH3COO-)-c(CH3COOH)=2[c(H+)-c(OH-)]
)=c(Cl-)>c(OH-)=c(H+) 曲线Ⅱ,滴加10 mL溶液时:c(CH3COO-)-c(CH3COOH)=2[c(H+)-c(OH-)]
曲线I.,滴加10mL溶液时:c(CH3CO—)>C.(Na+)>c(H+)>c(OH—) 曲线I.,滴加20mL溶液时:c(Cl—)=c(NH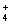 )>c(H+)=c(OH—) 曲线II,所滴加溶液在10mL~20mL之间时存在: c(NH
)>c(H+)=c(OH—) 曲线II,所滴加溶液在10mL~20mL之间时存在: c(NH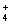 )= c(Cl—)> c(OH—)= c(H+) 曲线II,滴加10mL溶液时: c(CH3COO—)
)= c(Cl—)> c(OH—)= c(H+) 曲线II,滴加10mL溶液时: c(CH3COO—) c(CH3COOH)=2[c(H+)-c(OH—)]
c(CH3COOH)=2[c(H+)-c(OH—)]
曲线Ⅰ:滴加溶液到10 mL时: c(CH3COO-)>c(Na+)>c(H+)>c(OH-) 曲线Ⅰ:滴加溶液到20 mL时: c(Cl-)>c(NH4+)>c(H+)>c(OH-) 曲线Ⅱ:滴加溶液在10 mL~20 mL之间 存在:c(NH4+)=c(Cl-)>c(OH-)=c(H+) 曲线Ⅱ:滴加溶液到10 mL时: c(CH3COO-)-c(CH3COOH)=2[c(H+)-c(OH-)] 
向2mL蛋白稀释液中先加0.1g/mL的NaOH溶液,振荡均匀后,再加入3-4滴0.05g/mLCuSO4溶液 向2mL蛋白稀释液中先加0.1g/mL的NaOH溶液,振荡均匀后,再加入3-4滴0.01g/mLCuSO4溶液 向2mL蛋白稀释液中先加0.01g/mL的CuSO4溶液,振荡均匀后,再加入3-4滴0.1g/mLNaOH溶液 向2mL蛋白稀释液中同时加0.1g/mL的NaOH溶液和0.05g/mL的CuSO4溶液
滴加过程中当溶液呈中性时,V(NaOH)>20mL 当V(NaOH)=30mL时,则有:2c(Na+)=3c(A2-)+3c(HA-) H2A在水中的电离方程式是:H2A.=H++HA-;HA-  H++A2- 当V(NaOH)=20mL时,则有:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(0H-)
H++A2- 当V(NaOH)=20mL时,则有:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(0H-) 
当V(NaOH)=20 mL时,溶液中离子浓度大小关系: c(HA-) > c(Na+) > c(A2-) > c(H+) >c(OH-) 等浓度的NaOH溶液与H2A溶液按2:1混合后, 其溶液中水的电离程度比纯水大 NaHA溶液中:c(OH—)=c(H+)+c(HA–)+2c(H2A.) 向上述加入20mLNaOH溶液后所得溶液中再加入水的过程中,pH可能减小
当V(NaOH)=0时,由水电离出的c(H+)=1.0×10-7 当V(NaOH)=20 mL时, c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-) 当V(NaOH)=40 mL时,2c(Na+)=c(SO32-) 当V(NaOH)=40 mL后,继续滴加NaOH溶液,溶液的温度会继续升高

 随着V.[NaOH(aq)]的增大而减小 V.[NaOH(aq)]=20 mL时,溶液中存在关系:c(HA-)+c(A2-)+c(H2A.)=0.05 mol·L-1 V.[NaOH(aq)]=20 mL时,溶液中存在关系:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-)
随着V.[NaOH(aq)]的增大而减小 V.[NaOH(aq)]=20 mL时,溶液中存在关系:c(HA-)+c(A2-)+c(H2A.)=0.05 mol·L-1 V.[NaOH(aq)]=20 mL时,溶液中存在关系:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-)

 )>c(H+)>c(OH-) 曲线Ⅱ:滴加溶液在10 mL~20 mL之间存在:c(NH
)>c(H+)>c(OH-) 曲线Ⅱ:滴加溶液在10 mL~20 mL之间存在:c(NH )=c(Cl-)>c(OH-)=c(H+) 曲线Ⅱ:滴加溶液到10 mL时:c(CH3COO-)-c(CH3COOH)=2c(H+)-c(OH
)=c(Cl-)>c(OH-)=c(H+) 曲线Ⅱ:滴加溶液到10 mL时:c(CH3COO-)-c(CH3COOH)=2c(H+)-c(OH
 )>c(H+)=c(OH-) 曲线Ⅱ,所滴加溶液在10~20 mL之间时存在:c(NH
)>c(H+)=c(OH-) 曲线Ⅱ,所滴加溶液在10~20 mL之间时存在:c(NH )=c(Cl-)>c(OH-)=c(H+) 曲线Ⅱ,滴加10 mL溶液时:c(CH3COO-)-c(CH3COOH)=2[c(H+)-c(OH-)]
)=c(Cl-)>c(OH-)=c(H+) 曲线Ⅱ,滴加10 mL溶液时:c(CH3COO-)-c(CH3COOH)=2[c(H+)-c(OH-)]
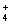 )>c(H+)=c(OH—) 曲线II,所滴加溶液在10mL~20mL之间时存在: c(NH
)>c(H+)=c(OH—) 曲线II,所滴加溶液在10mL~20mL之间时存在: c(NH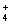 )= c(Cl—)> c(OH—)= c(H+) 曲线II,滴加10mL溶液时: c(CH3COO—)
)= c(Cl—)> c(OH—)= c(H+) 曲线II,滴加10mL溶液时: c(CH3COO—) c(CH3COOH)=2[c(H+)-c(OH—)]
c(CH3COOH)=2[c(H+)-c(OH—)]

 H++A2- 当V(NaOH)=20mL时,则有:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(0H-)
H++A2- 当V(NaOH)=20mL时,则有:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(0H-) 