你可能感兴趣的试题
该电池工作时,正极反应为:2AgCl+2e-=2Cl-+2Ag 镁电极作该电池负极,负极反应为:Mg-2e-=Mg2+ 当有24g Mg被氧化时,有108 g Ag被还原。 装备该电池的鱼雷在水中行进时,海水作为电解质溶液
负极反应式为Mg - 2e-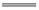 Mg2+ 正极反应式为Ag+ + e-
Mg2+ 正极反应式为Ag+ + e-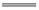 Ag 电池放电时Cl-由正极向负极迁移 负极会发生副反应Mg + 2H2O
Ag 电池放电时Cl-由正极向负极迁移 负极会发生副反应Mg + 2H2O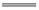 Mg(OH)2 + H2↑
Mg(OH)2 + H2↑
正极反应式为Ag+ + e– ═ Ag 电池放电时Cl– 由正极向负极迁移 负极反应式为Mg – 2e– ═ Mg2+ 负极会发生副反应Mg + 2H2O ═ Mg(OH)2 + H2↑
Mg为电池的正极 负极反应为AgCl+e-===Ag+Cl- 不能被KCl 溶液激活 可用于海上应急照明供电
负极反应式为Mg–2e–=Mg2+ 正极反应式为Ag++e–=Ag 电池放电时Cl-由正极向负极迁移 负极会发生副反应Mg+2H2O=Mg(OH)2+H2↑
Mg为电池的正极 负极反应为AgCl+e- Ag+Cl- 不能被KCl溶液激活 可用于海上应急照明供电
Ag+Cl- 不能被KCl溶液激活 可用于海上应急照明供电
Mg为电池的正极 负极反应为AgCl+e-===Ag+Cl- 不能被KCl溶液激活 可用于海上应急照明供电
负极反应式为Mg—2e-=Mg2+ 正极反应式为Ag++e-=Ag 电池放电时Cl一由正极向负极迁移 负极会发生副反应 Mg+2H2O=Mg(OH)2+H2↑
负极反应式为Mg-2e-=Mg2+ 正极反应式为Ag++e-=Ag 电池放电时Cl-由正极向负极迁移 负极会发生副反应Mg+2H2O=Mg(OH)2+H2↑
负极反应式为Mg–2e–=Mg2+ 正极反应式为Ag++e–=Ag 电池放电时Cl–由正极向负极迁移 负极会发生副反应Mg+2H2O=Mg(OH)2+H2↑
负极反应式为Mg-2e-===Mg2+ 正极反应式为Ag++e-===Ag 电池放电时Cl-由正极向负极迁移 负极会发生副反应Mg+2H2O===Mg(OH)2+H2↑
负极反应式为Mg–2e–=Mg2+ 电池放电时Cl–由正极向负极迁移 正极反应式为Ag++e–=Ag 负极会发生副反应Mg+2H2O=Mg(OH)2+H2↑
负极反应式为Mg—2e-=Mg2+ 正极反应式为Ag++e-=Ag 电池放电时Cl一由正极向负极迁移 负极会发生副反应 Mg+2H2〇=Mg(OH)2+H2↑
Mg为电池的正极 负极反应为AgCl+e- Ag+Cl- 不能被KCl溶液激活 可用于海上应急照明供电
Ag+Cl- 不能被KCl溶液激活 可用于海上应急照明供电
石墨电极是该电池的正极 石墨电极上发生还原反应 Mg电极的电极反应式:Mg-2e-=Mg2+ 电池工作时,电子从Mg电极经导线流向石墨电极,再出石墨电极经电解质溶液流向Mg电极
负极反应式为Mg – 2e― == Mg2+ 正极反应式为Ag+ + e―== Ag 电池放电时Cl―由正极向负极迁移 负极会发生副反应Mg + 2H2O == Mg(OH)2 + H2↑
负极反应式为Mg - 2e-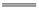 Mg2+ 正极反应式为Ag+ + e-
Mg2+ 正极反应式为Ag+ + e-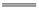 Ag 电池放电时Cl-由正极向负极迁移 负极会发生副反应Mg + 2H2O
Ag 电池放电时Cl-由正极向负极迁移 负极会发生副反应Mg + 2H2O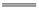 Mg(OH)2 + H2↑
Mg(OH)2 + H2↑
AgCl为电池的正极 正极反应为Ag++e-=Ag 该电池一定不能被MgCl2溶液激活 可用于海上应急照明供电,直接将化学能转化为光能
负极反应式为Mg - 2e-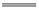 Mg2+ 正极反应式为Ag+ + e-
Mg2+ 正极反应式为Ag+ + e-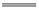 Ag 电池放电时Cl-由正极向负极迁移 负极会发生副反应Mg + 2H2O
Ag 电池放电时Cl-由正极向负极迁移 负极会发生副反应Mg + 2H2O Mg(OH)2 + H2↑
Mg(OH)2 + H2↑

 Mg2+ 正极反应式为Ag+ + e-
Mg2+ 正极反应式为Ag+ + e- Ag 电池放电时Cl-由正极向负极迁移 负极会发生副反应Mg + 2H2O
Ag 电池放电时Cl-由正极向负极迁移 负极会发生副反应Mg + 2H2O Mg(OH)2 + H2↑
Mg(OH)2 + H2↑
 Ag+Cl- 不能被KCl溶液激活 可用于海上应急照明供电
Ag+Cl- 不能被KCl溶液激活 可用于海上应急照明供电
 Ag+Cl- 不能被KCl溶液激活 可用于海上应急照明供电
Ag+Cl- 不能被KCl溶液激活 可用于海上应急照明供电
 Mg2+ 正极反应式为Ag+ + e-
Mg2+ 正极反应式为Ag+ + e- Ag 电池放电时Cl-由正极向负极迁移 负极会发生副反应Mg + 2H2O
Ag 电池放电时Cl-由正极向负极迁移 负极会发生副反应Mg + 2H2O Mg(OH)2 + H2↑
Mg(OH)2 + H2↑
 Mg2+ 正极反应式为Ag+ + e-
Mg2+ 正极反应式为Ag+ + e- Ag 电池放电时Cl-由正极向负极迁移 负极会发生副反应Mg + 2H2O
Ag 电池放电时Cl-由正极向负极迁移 负极会发生副反应Mg + 2H2O Mg(OH)2 + H2↑
Mg(OH)2 + H2↑