你可能感兴趣的试题
C(s)+O2(g)→CO2(g) 2SO2(g)+O2(g)→2SO3(g) 3H2(g)+N2(g)→2NH3(g) CuSO4(s)+5H2O(l)→CuSO4•5H2O(s)
SO2能使FeCl3、KMnO4溶液迅速褪色 可以用澄清石灰水来鉴别SO2与CO2 硫粉在过量的纯氧中燃烧可以生成SO3 冷的浓硫酸和浓硝酸可以用铁桶装
新平衡体系中,SO2和O2物质的量之比仍为2∶1 平衡向正反应方向移动,原因是正反应速率增大,逆反应速率减小 新平衡体系与旧平衡体系比较,SO3的浓度肯定增大 若所采取的措施是缩小容器的容积,则新旧平衡中SO2和O2的转化率之比都是1∶1
生成 SO3 为2 mol SO2 和 SO3 物质的量之和一定为 3 mol 消耗SO2 的速率等于生成O2的速率 SO2 的物质的量和SO3 物质的量一定相等
1L1mol·L.-1的NaClO 溶液中含有ClO-的数目为NA 将1mol氨气溶于水中形成1L溶液,c(NH3·H2O)+c(NH4+)=1mol/L pH=a的氨水,稀释10倍后,其pH=b,则a=b+1 已知2SO2(g)+O2(g) 2SO3(g) ΔH=-akJ/mol;在相同条件下,2mol气态SO2和1mol氧气反应生成气态三氧化硫,释放出的热量小于akJ
SO2 、O2 SO2 、SO3 SO2 、O2 、SO3 O2 、SO3
Qc不变,K.变大,O2转化率增大 Qc不变,K.变大,SO2转化率减小 Qc变小,K.不变,O2转化率减小 Qc增大,K.不变,SO2转化率增大 示
有l/2摩+6价的S.被还原 有1/3摩一3价的N.被氧化 有2/3摩(NH4)2SO4分解 有3/4摩SO2生成
准确称取0.4000 g NaOH固体可配成100 mL 0.1000 mol·L-1的NaOH标准溶液 已知Ksp[Fe(OH)3]=4.0×10-38,则Fe3++3H2O Fe(OH)3+3H+的平衡常数K=2.5×10-5 100 mL pH=3的HA和HB分别与足量的锌反应,HB放出的氢气多,说明HB酸性比HA弱 对于反应2SO2(g)+O2(g)
Fe(OH)3+3H+的平衡常数K=2.5×10-5 100 mL pH=3的HA和HB分别与足量的锌反应,HB放出的氢气多,说明HB酸性比HA弱 对于反应2SO2(g)+O2(g) 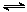 2SO3(g),压缩气体体积使压强增大(其他条件不变),则SO2的转化率增大,平衡常数K.也增大
2SO3(g),压缩气体体积使压强增大(其他条件不变),则SO2的转化率增大,平衡常数K.也增大
①表示Na2CO3溶液中滴入稀盐酸 ②表示溴水中滴入Na2SO3溶液 ③表示AgNO3溶液中滴入氨水 ④表示一定条件下2SO2+O2 2SO3 △H<0达平衡后,升高温度
2SO3 △H<0达平衡后,升高温度
增加SO2的浓度,正反应速率先增大,后保持不变 增加SO2的浓度,正反应速率逐渐增大 增加SO2的浓度,平衡常数增大 增加SO2的浓度,平衡常数不变
该温度下反应2SO2(g)+2NO2(g)  2SO3(g)+2NO(g)的平衡常数为0.48 若该反应ΔH<0,则升高温度化学平衡常数K.减小 若升高温度,逆反应速率减小 改变条件使平衡正向移动,则平衡时n(NO2)/n(NO)一定比原平衡小
2SO3(g)+2NO(g)的平衡常数为0.48 若该反应ΔH<0,则升高温度化学平衡常数K.减小 若升高温度,逆反应速率减小 改变条件使平衡正向移动,则平衡时n(NO2)/n(NO)一定比原平衡小
SO2和O2不再化合,反应停止了 容器内压强保持不变
SO2、O2和SO3的浓度相等 SO2、O2和SO3的物质的量之比为2:1:2
使用催化剂可以提高SO2的转化率 增大O2的浓度可以提高反应速率和SO2的转化率 反应450℃时的平衡常数小于500℃时的平衡常数 增大平衡后的体系压强, v正增大,v逆减小,平衡向正反应方向移动
温度T2>T1 反应达到平衡后放出99 kJ的热量 Y.可能是SO2的转化率或SO3的浓度 反应达到平衡后容器内气体的密度减小
BaSO3和BaSO4 BaS BaSO3 BaSO4

 Fe(OH)3+3H+的平衡常数K=2.5×10-5 100 mL pH=3的HA和HB分别与足量的锌反应,HB放出的氢气多,说明HB酸性比HA弱 对于反应2SO2(g)+O2(g)
Fe(OH)3+3H+的平衡常数K=2.5×10-5 100 mL pH=3的HA和HB分别与足量的锌反应,HB放出的氢气多,说明HB酸性比HA弱 对于反应2SO2(g)+O2(g) 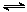 2SO3(g),压缩气体体积使压强增大(其他条件不变),则SO2的转化率增大,平衡常数K.也增大
2SO3(g),压缩气体体积使压强增大(其他条件不变),则SO2的转化率增大,平衡常数K.也增大
 2SO3 △H<0达平衡后,升高温度
2SO3 △H<0达平衡后,升高温度
 2SO3(g)+2NO(g)的平衡常数为0.48 若该反应ΔH<0,则升高温度化学平衡常数K.减小 若升高温度,逆反应速率减小 改变条件使平衡正向移动,则平衡时n(NO2)/n(NO)一定比原平衡小
2SO3(g)+2NO(g)的平衡常数为0.48 若该反应ΔH<0,则升高温度化学平衡常数K.减小 若升高温度,逆反应速率减小 改变条件使平衡正向移动,则平衡时n(NO2)/n(NO)一定比原平衡小
