你可能感兴趣的试题
反应物或生成物浓度的改变对平衡常数油影响 平衡常数只随温度变化而变化 平衡常数表示反应的进行程度 平衡常数的值越小说明正反应进行的程度大
电离平衡常数越小,表示弱电解质的电离能力越弱 电离平衡常数与温度无关 不同浓度的同一弱电解质,其电离平衡常数不同 多元弱酸各步电离平衡常数相互关系为:K1〈K2〈K3
相平衡常数与总压成正比 越易挥发的组分,其蒸汽压越大,平衡常数越小 平衡常数随温度、压力变化较小 平衡温度高、蒸汽压力大、平衡常数也大
电离平衡常数(K.)与温度无关 H2CO3的电离常数表达式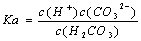 同温下,电离平衡常数越小表示弱电解质电离能力越弱 多元弱酸各步电离平衡常数相互关系为:K123
同温下,电离平衡常数越小表示弱电解质电离能力越弱 多元弱酸各步电离平衡常数相互关系为:K123
不同的可逆反应,反应物的性质不同,平衡常数是相等的 对可逆反应来说,平衡常数越大,表示反应达到平衡时生成物浓度和反应物浓度的比值越大 对于同一个可逆反应,在不同的温度下,平衡常数有相同的数值 对可逆反应来说,平衡常数越大,表示反应完成的程度越小,物质的转化率越大
不同浓度的同一弱电解质,其电离常数(K.)不同 温度越高,化学平衡常数一定越大 平衡常数发生变化,化学平衡必定发生移动,达到新的平衡 化学平衡发生移动,平衡常数必发生变化
温度:T1>T2>T3 正反应速率:v(a)>v(c) v(b)>v(d) 平衡常数:K(a)>K(c) K(b)=K(d) 平均摩尔质量:M(a)M(d)
在任何条件下,化学平衡常数是一个恒定值 改变反应物浓度或生成物浓度都会改变平衡常数K. 平衡常数K.只与温度有关,与反应物浓度、压强无关 从平衡常数K.的大小不能推断一个反应进行的程度
平均摩尔质量:a>c b正反应速率:a>c b>d 平衡常数:a>b b=d 平衡时a点一定满足CO与H2的物质的量之比为1:2
[H+]随温度的升高而降低 水的电离过程是吸热的 水的电离平衡常数与浓度、温度有关 在35℃时,[H+] > [OH─]
在平衡常数表达式中,反应物浓度用初始浓度,生成物浓度用平衡浓度 在任何条件下,化学平衡常数是一个恒定值 平衡常数的大小只与浓度有关,而与温度、压强、催化剂等无关 从平衡常数的大小可以推断一个反应进行的程度
达平衡后升温,反应速率增大,压强减小 其他条件不变,增加压强能提高CO的转化率 该反应ΔH.>0 830℃时,在2L.的密闭容器中加入4 mol CO(g)和4 mol H2O(g),平衡时,CO的转化率是50%
不同的可逆反应,反应物的性质不同,平衡常数是相同的 对可逆反应来说,平衡常数越大,表示反应达到平衡时生成物浓度和反应物浓度的比值越大 对于同一个可逆反应,在不同温度下,平衡常数有相同的数值 对于可逆反应来说,平衡常数越大,也就是反应完成的程度越小,物质的转化率越大
电离度越大,电离平衡常数越大; 浓度越稀,电离度越大,电离平衡常数越大; 在相同的温度下电离度可变,而电离平衡常数不变; 多元弱酸的每一步电离平衡常数是相同的
不同的可逆反应,反应物的性质不同,平衡常数是相同的 对可逆反应来说,平衡常数越大,表示反应达到平衡时生成物浓度和反应物浓度的比值越大 对于同一个可逆反应,在不同温度下,平衡常数有相同的数值 对可逆反应来说,平衡常数越大,也就是反应完成的程度越小,物质的转化率越大
在任何条件下,化学平衡常数是一个恒定值 改变反应物浓度或生成物浓度都会改变平衡常数K. 平衡常数K.只与温度有关,与反应浓度、压强无关 从平衡常数K.的大小不能推断一个反应进行的程度

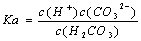 同温下,电离平衡常数越小表示弱电解质电离能力越弱 多元弱酸各步电离平衡常数相互关系为:K1
同温下,电离平衡常数越小表示弱电解质电离能力越弱 多元弱酸各步电离平衡常数相互关系为:K1