你可能感兴趣的试题
水玻璃中通入过量二氧化碳:Na2SiO3 +CO2 + H2O==2Na+ +CO32-+H2SiO3 Na2O2 加入H218O 中:2Na2O2+2H2l8O ==4Na++4OH-+18O2↑ 硅与氢氟酸的反应:Si+4H++4F-==SiF4↑+2H2↑ 过量CO2通入氢氧化钙溶液中:CO2+OH-==HCO3-
CO的燃烧热为283 kJ 右图可表示由CO生成CO2的反应过程和能量关系 2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g) △H= - 452 kJ/mol CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数为2x6.02×l023
CO的标准燃烧热为283 kJ 下图可表示由CO生成CO2的反应过程和能量关系 2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g) ΔH>-532 kJ·mol-1 CO(g)与Na2O2(s)反应放出549 kJ热量时,电子转移数为6.02×1023
CO的燃烧热为566 kJ/mol 右图可表示由CO生成CO2的反应过程和能量关系 2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g) ΔH.>-452 kJ/mol CO2(g)与Na2O2(s)反应放出452kJ热量时,电子转移的物 质的量为为2 mol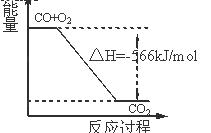
H2SO4+2NaOH==Na2SO4+2H2O 2NaHCO3 Na2CO3+CO2↑+H2O NH3+HCl==NH4Cl CuO+H2
Na2CO3+CO2↑+H2O NH3+HCl==NH4Cl CuO+H2 Cu+H2O
Cu+H2O
Na2CO3+2HCl== 2NaCl+H.2O.+CO2↑ 2NaOH+H.2SO4== Na2SO4+2H2O. SO2+2NaOH== Na2SO3+H.2O Zn+CuSO4===ZnSO4+Cu
Cl2+2KBr ===Br2+2KCl 2NaHCO3 Na2CO3+H2O+CO2↑ 4Fe(OH)2+O2+2H2O===4Fe(OH)3 2Na2O2+2CO2===2Na2CO3+O2
Na2CO3+H2O+CO2↑ 4Fe(OH)2+O2+2H2O===4Fe(OH)3 2Na2O2+2CO2===2Na2CO3+O2
2Na+2H2O=2NaOH+H2↑ 2HgO 2Hg+O2↑ Na2CO3+2HCl=2NaCl+CO2↑+H2O. Fe2O.3+3CO 2Fe+3CO2
C+2CuO====2Cu+CO2↑ 2H2O2=======2H2O+O2↑ C2H5OH+3O2======2CO2+3H2O Na2CO3+Ca(OH)2===CaCO3↓+2NaOH
CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数为NA 上图可表示由2molCO和1molO2生成2molCO2的反应过程 和能量关系 2Na2O2(s)+2CO2(s)===2Na2CO3(s)+O2(g) Δ H>-452 kJ/mol CO的燃烧热为283 kJ/mol
Cl2+2KBr===Br2+2KCl 2NaHCO3 Na2CO3+H2O+CO2↑ 4Fe(OH)2+O2+2H2O===4Fe(OH)3 2Na2O2+2CO2===2Na2CO3+O2
Na2CO3+H2O+CO2↑ 4Fe(OH)2+O2+2H2O===4Fe(OH)3 2Na2O2+2CO2===2Na2CO3+O2
Na2CO3+2HCl===2NaCl+H2O+CO2↑ 2NaOH+H2SO4===Na2SO4+2H2O CO2+2NaOH===Na2CO3+H2O Fe+CuSO4===Cu+FeSO4
CO的燃烧热ΔH.=-283 kJ 下图可表示由CO生成CO2的反应过程和能量关系 2Na2O2(s)+2CO2(s)===2Na2CO3(s)+O2(g) ΔH>-452 kJ·mol-1 CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数为6.02×1023
Na2CO3+2HCl===2NaCl+H2O+CO2↑ 2NaOH+H2SO4===Na2SO4+2H2O CO2+2NaOH===Na2CO3+H2O Fe+CuSO4===Cu+FeSO4
反应(1)和(2)均为氧化还原反应 反应(1)的氧化剂是O2,还原剂是FeO·Cr2O3 高温下,O2的氧化性强于Fe2O3,弱于Na2CrO4 反应(1)中每生成1molNa2CrO4时电子转移3mol
CO的燃烧热为283 kJ 下图可表示由CO生成CO2的反应过程和能量关系  CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数为6.02×1023 2Na2O2(s)+2CO2(s)===2Na2CO3(s)+O2(g) ΔH>-452 kJ·mol-1
CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数为6.02×1023 2Na2O2(s)+2CO2(s)===2Na2CO3(s)+O2(g) ΔH>-452 kJ·mol-1
CO的燃烧热为283 kJ 两个反应都只发生了共价键的断裂和形成 CO2(g)与Na2O2(s)反应放出452kJ热量时,电子转移数为6.02×1023 Na2O2(s)+CO(g)===Na2CO3(s) ΔH=-509 kJ/mol.


 Na2CO3+CO2↑+H2O NH3+HCl==NH4Cl CuO+H2
Na2CO3+CO2↑+H2O NH3+HCl==NH4Cl CuO+H2 Cu+H2O
Cu+H2O
 Na2CO3+H2O+CO2↑ 4Fe(OH)2+O2+2H2O===4Fe(OH)3 2Na2O2+2CO2===2Na2CO3+O2
Na2CO3+H2O+CO2↑ 4Fe(OH)2+O2+2H2O===4Fe(OH)3 2Na2O2+2CO2===2Na2CO3+O2
 Na2CO3+H2O+CO2↑ 4Fe(OH)2+O2+2H2O===4Fe(OH)3 2Na2O2+2CO2===2Na2CO3+O2
Na2CO3+H2O+CO2↑ 4Fe(OH)2+O2+2H2O===4Fe(OH)3 2Na2O2+2CO2===2Na2CO3+O2
 CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数为6.02×1023 2Na2O2(s)+2CO2(s)===2Na2CO3(s)+O2(g) ΔH>-452 kJ·mol-1
CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数为6.02×1023 2Na2O2(s)+2CO2(s)===2Na2CO3(s)+O2(g) ΔH>-452 kJ·mol-1