你可能感兴趣的试题
Pb(Ac)2+H2S = PbS↓+2HAc Pb2++H2S = PbS↓+2H+ Pb2++2Ac-+H2S = PbS↓+2HAc Pb2++2Ac-+2H++S2- =PbS↓+2HAc
往平衡体系中加入金属铅后,c(Pb2+)增大 往平衡体系中加入少量Sn(NO3)2固体后,c(Pb2+)变小 升高温度,平衡体系中c(Pb2+)增大,说明该反应△H>0 25℃时,该反应的平衡常数K.=2.2
铅的最高价氧化物对应的水化物是酸性比硅酸还弱的酸 PbO2的氧化性不如PbO的氧化性强 Pb3O4可以写成PbO・Pb2O3的形式 溶液中Pb2+比Pb4+稳定
锗.锡在空气中不反应,铅在空气中表面生成一层氧化铅
锗与盐酸不反应,锡.铅能与盐酸反应
锗.锡.铅的+4价氢氧化物的碱性:Ge(OH)4<Sn(OH)4<Pb(OH)4
锗.锡.铅的金属性依次减弱
Pb(Ac)2+H2S==PbS↓+2Hac Pb2++H2S==PbS↓+2H+ Pb2++2Ac-+H2S==PbS↓+2Hac Pb2++2Ac-+2H++S2-==PbS↓+2HAc
Pb(Ac)2+H2S=PbS↓+2HAc
Pb2++H2S=PbS↓+2H+
Pb2++2Ac-+H2S=PbS↓+2HAc
Pb2++2Ac-+2H++S2-=PbS↓+2HAc
Pb(Ac)2+H2S = PbS↓+2H Ac Pb2++H2S = PbS↓+2H+ Pb2++2Ac-+H2S = PbS↓+2H Ac Pb2++2Ac-+2H++S2- = PbS↓+2HAc
0.1 mol·L-1的“铅糖”溶液中c(Pb2+)< 0.1 mol·L-1 “铅糖”是强电解质 “铅糖”是共价化合物 “铅糖”的溶液可能不导电
往平衡体系中加入金属铅后,c(Pb2+)增大 往平衡体系中加入少量Sn(NO3)2固体后,c(Pb2+)变小 升高温度,平衡体系中c(Pb2+)增大,说明该反应△H.>0 25℃时,该反应的平衡常数K.=2.2 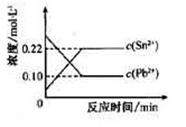
Pb(Ac)2+H2S=PbS↓+2HAc
Pb2++H2S=PbS↓+2H+
Pb2++2Ac-+H2S=PbS↓+2HAc
Pb2++2Ac-+2H++S2-=PbS↓+2HAc
往平衡体系中加入金属铅后,c(Pb2+)增大 往平衡体系中加入少量Sn(NO3)2固体后,c(Pb2+)变小 升高温度,平衡体系中c(Pb2+)增大,说明该反应△H.>0 25℃时,该反应的平衡常数K.=2.2
与同族硅元素类似,锗.锡.铅都可用做半导体材料 锗与盐酸可能不反应,锡.铅能与盐酸反应 锗.锡.铅的+4价氢氧化物的碱性由弱到强的顺序为:Ge(OH)4<Sn(OH)4<Pb(OH)4 锗.锡.铅的金属性依次减弱

