你可能感兴趣的试题
由图甲可以判断:若T1>T2,反应A.(g)+ B(g) 2C(g)的△H<0 图乙表示压强对可逆反应2A(g)+2 B(g)
2C(g)的△H<0 图乙表示压强对可逆反应2A(g)+2 B(g) 3C(g)+D(s)的影响,乙的压强比甲的压强大 根据图丙,若除去CuSO4溶液中的Fe3+,可向溶液中加入适量NaOH溶液,调节pH≈4 图丁表示用0.1mol/L的盐酸滴定20mL 0.1mol/LNaOH溶液,溶液pH随加入盐酸体积的变化
3C(g)+D(s)的影响,乙的压强比甲的压强大 根据图丙,若除去CuSO4溶液中的Fe3+,可向溶液中加入适量NaOH溶液,调节pH≈4 图丁表示用0.1mol/L的盐酸滴定20mL 0.1mol/LNaOH溶液,溶液pH随加入盐酸体积的变化
图甲表示向乙酸溶液中通入NH3过程中溶液导电性的变化 由图乙可知若除去CuSO4溶液中的Fe3+可采用向溶液中加入适量CuO至pH在4左右 图丙表示25°C时,用0.1mol/L盐酸滴定20mL 0.1mol·L﹣1氨水,溶液的pH随加入盐酸体积的变化 图丁表示向Al2(SO4)3溶液中滴入NaOH溶液,生成Al(OH)3沉淀的量随NaOH溶液体积的变化
图1表示常温下,将SO2气体通入溴水中,所得溶液pH的变化 图2表示向NH4Al(SO4)2溶液中逐滴滴入NaOH溶液,沉淀总物质的量(n)随NaOH溶液体积(V)的变化 图3表示T °C时,对于可逆反应:A(g)+B(g) 2C(g) +D(g)ΔH>0,正、逆反应速率与压强的关系 图4表示常温下,几种难溶氢氧化物的饱和溶液中金属离子浓度的负对数与溶液PH的关系,则在pH = 7的溶液中,Fe3+、Al3+、Fe2+能大量共存
2C(g) +D(g)ΔH>0,正、逆反应速率与压强的关系 图4表示常温下,几种难溶氢氧化物的饱和溶液中金属离子浓度的负对数与溶液PH的关系,则在pH = 7的溶液中,Fe3+、Al3+、Fe2+能大量共存
图甲表示向乙酸溶液中通入NH3过程中溶液导电性的变化 由图乙可知若除去CuSO4溶液中的Fe3+可采用向溶液中加入适量CuO至pH在4左右 图丙表示25°C时,用0.1mol/L盐酸滴定20mL 0.1mol·L﹣1氨水,溶液的pH随加入盐酸体积的变化 图丁表示向Al2(SO4)3溶液中滴入NaOH溶液,生成Al(OH)3沉淀的量随NaOH溶液体积的变化
图1表示向某硫酸和硫酸铝混合溶液中加入NaOH溶液,沉淀质量与加入NaOH溶液体积的关系 图2表示25℃时,用0.1mol?L-1盐酸滴定20mL0.1mol?L-1NaOH溶液的pH随加入盐酸体积的变化 图3表示t℃时稀释冰醋酸过程中溶液导电性的变化 根据图4可判断某可逆反应的正反应是吸热反应
图甲表示压强对反应2A(g)+2B(g) 3C(g)+D(s)的影响,且P2 > PI 图乙表示25℃时,用0.1 mol/L盐酸滴定20 mL 0.1 mol/L NaOH溶液, 溶液的pH随加入盐酸体积的变化 依据图丙,若除去CuSO4溶液中的Fe3+,可向溶液中加入适量CuO, 调节pH≈4 图丁中开关K.置于A.或B.处均可以减缓铁的腐蚀
3C(g)+D(s)的影响,且P2 > PI 图乙表示25℃时,用0.1 mol/L盐酸滴定20 mL 0.1 mol/L NaOH溶液, 溶液的pH随加入盐酸体积的变化 依据图丙,若除去CuSO4溶液中的Fe3+,可向溶液中加入适量CuO, 调节pH≈4 图丁中开关K.置于A.或B.处均可以减缓铁的腐蚀
图①表示向AlCl3溶液中滴入NaOH的物质的量与沉淀质量的变化关系 图②表示25 ℃时,用0.01 mol·L-1盐酸滴定20 mL 0.01 mol·L-1 NaOH溶液,溶液的pH随加入酸体积的变化关系 图③表示向Na2CO3稀溶液中滴入稀盐酸,产生气体的体积随加入HCl物质的量的变化关系 图④表示合成氨反应在一定条件下N2、NH3浓度随时间的变化关系
图①表示向20 mL 0.1 mol/L氨水中逐滴加入0.1 mol/L醋酸,溶液导电性随加入酸体积的变化 图②表示压强对可逆反应A.(g)+2B(g) 3C(g)+D(s)的影响,乙比甲的压强大 图③中曲线表示反应3A(g) + B(g)
3C(g)+D(s)的影响,乙比甲的压强大 图③中曲线表示反应3A(g) + B(g) 2C(g)△H<0,正、逆反应的平衡常数K.随温度的变化 据图④,若要除去CuSO4溶液中的Fe3+,可加入NaOH溶液至pH在4左右
2C(g)△H<0,正、逆反应的平衡常数K.随温度的变化 据图④,若要除去CuSO4溶液中的Fe3+,可加入NaOH溶液至pH在4左右
稀硫酸中不断滴入NaOH溶液 NaOH溶液中不断滴入稀硫酸
NaOH溶液中不断滴入纯水 稀硫酸中加入锌粒
Ⅰ为醋酸稀释时pH变化曲线 溶液的导电性:b>a>c 取“0”处等体积的两者溶液分别加足量铁粉,放出H2的量:醋酸>盐酸 取5mL处等体积两者溶液分别与相同的Zn粒反应,开始时的反应速率:Ⅰ>Ⅱ 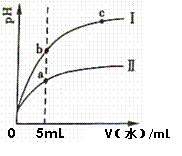
Ⅰ为醋酸稀释时pH变化曲线 溶液的导电性:b>a>c 取“0”处等体积的两者溶液分别加足量铁粉,放出H2的量:醋酸>盐酸 取5mL处等体积两者溶液分别与相同的Zn粒反应,开始时的反应速率:Ⅰ>Ⅱ
图Ⅰ表示盐酸滴加到0.1 mol/L某碱溶液得到的滴定曲线,用已知浓度盐酸滴定未知浓度该碱时最好选取酚酞作指示剂 图Ⅱ表示一定条件下进行的反应2SO2+O2 2SO3 各成分的物质的量变化,t2时刻改变的条件可能是缩小容器体积 图Ⅲ表示某明矾溶液中加入Ba(OH)2溶液,沉淀的质量与加入Ba(OH)2溶液体积的关系,在加入20 mL Ba(OH)2 溶液时铝离子恰好沉淀完全 图Ⅳ表示pH相同的盐酸与醋酸中分别加入水后溶液pH的变化,其中曲线a对应的是盐酸
2SO3 各成分的物质的量变化,t2时刻改变的条件可能是缩小容器体积 图Ⅲ表示某明矾溶液中加入Ba(OH)2溶液,沉淀的质量与加入Ba(OH)2溶液体积的关系,在加入20 mL Ba(OH)2 溶液时铝离子恰好沉淀完全 图Ⅳ表示pH相同的盐酸与醋酸中分别加入水后溶液pH的变化,其中曲线a对应的是盐酸
a的数值一定大于9 Ⅱ为氨水稀释时溶液的pH变化曲线 稀释后氨水中水的电离程度比NaOH溶液中水的电离程度大 完全中和相同体积的两溶液时,消耗相同浓度的稀硫酸的体积:V(NaOH)
图1表示向某硫酸和硫酸铝混合溶液中加入NaOH溶液,沉淀质量与加入NaOH溶液体积的关系 图2表示25℃时,用0.1mol•L-1盐酸滴定20mL0.1mol•L-1NaOH溶液的pH随加入盐酸体积的变化 图3表示t℃时稀释冰醋酸过程中溶液导电性的变化 根据图4可判断某可逆反应的正反应是吸热反应
图1表示向某硫酸和硫酸铝混合溶液中加入NaOH溶液,沉淀质量与加入NaOH溶液体积的关系 图2表示25℃时,用0.1mol?L-1盐酸滴定20mL0.1mol?L-1NaOH溶液的pH随加入盐酸体积的变化 图3表示t℃时稀释冰醋酸过程中溶液导电性的变化 根据图4可判断某可逆反应的正反应是吸热反应
图I.表示盐酸滴加到0.1mol/L某碱溶液中得到的滴定曲线,由图I.可知二者恰好中和时,所得溶液的PH=7 图II表示一定条件下进行的反应2SO2+O2 2SO3 ΔH<0各成分的物质的量变化,t2时刻改变的条件可能是加压或降低温度 图III表示某明矾溶液中加入Ba(OH)2溶液,沉淀的质量与加入Ba(OH)2溶液体积的关系,在加入20mlBa(OH)2溶液时,沉淀是Al(OH)3和BaSO4的混合物 图IV表示向一定体积含等浓度NH4Cl、AlCl3、MgCl2混合溶液中逐渐加入NaOH溶液至过量的过程中,生成沉淀的质量与加入NaOH溶液的体积之间的关系
2SO3 ΔH<0各成分的物质的量变化,t2时刻改变的条件可能是加压或降低温度 图III表示某明矾溶液中加入Ba(OH)2溶液,沉淀的质量与加入Ba(OH)2溶液体积的关系,在加入20mlBa(OH)2溶液时,沉淀是Al(OH)3和BaSO4的混合物 图IV表示向一定体积含等浓度NH4Cl、AlCl3、MgCl2混合溶液中逐渐加入NaOH溶液至过量的过程中,生成沉淀的质量与加入NaOH溶液的体积之间的关系
图甲表示向盐酸溶液中通入NH3过程中溶液导电性的变化 由图乙可知,若除去CuSO4溶液中的Fe3+可采用向溶液中加入适量CuO至pH在4左右 图丙表示25 ℃时,用0.1 mol·L-1盐酸滴定20 mL 0.1 mol·L-1氨水,溶液的pH随加入盐酸体积的变化 图丁表示向Al2(SO4)3溶液中滴入NaOH溶液,生成Al(OH)3沉淀的量随NaOH溶液体积的变化
图①表示25℃时,用0.1 mol·L-1盐酸滴定20 mL 0.1 mol·L-1NaOH溶液,溶液的pH随加入酸体积的变化 图②中曲线表示反应2A(g) + B(g) 2C(g) ΔH > 0,正、逆反应的平衡常数K.随温度的变化 图③表示压强对可逆反应2A(g)+2B(g)
2C(g) ΔH > 0,正、逆反应的平衡常数K.随温度的变化 图③表示压强对可逆反应2A(g)+2B(g)  3C(g)+D(s)的影响,乙的压强比甲的压强大 据图④若除去CuSO4溶液中的Fe3+可向溶液中加入适量CuO至pH在4左右。
3C(g)+D(s)的影响,乙的压强比甲的压强大 据图④若除去CuSO4溶液中的Fe3+可向溶液中加入适量CuO至pH在4左右。

 2C(g)的△H<0 图乙表示压强对可逆反应2A(g)+2 B(g)
2C(g)的△H<0 图乙表示压强对可逆反应2A(g)+2 B(g) 3C(g)+D(s)的影响,乙的压强比甲的压强大 根据图丙,若除去CuSO4溶液中的Fe3+,可向溶液中加入适量NaOH溶液,调节pH≈4 图丁表示用0.1mol/L的盐酸滴定20mL 0.1mol/LNaOH溶液,溶液pH随加入盐酸体积的变化
3C(g)+D(s)的影响,乙的压强比甲的压强大 根据图丙,若除去CuSO4溶液中的Fe3+,可向溶液中加入适量NaOH溶液,调节pH≈4 图丁表示用0.1mol/L的盐酸滴定20mL 0.1mol/LNaOH溶液,溶液pH随加入盐酸体积的变化
 2C(g) +D(g)ΔH>0,正、逆反应速率与压强的关系 图4表示常温下,几种难溶氢氧化物的饱和溶液中金属离子浓度的负对数与溶液PH的关系,则在pH = 7的溶液中,Fe3+、Al3+、Fe2+能大量共存
2C(g) +D(g)ΔH>0,正、逆反应速率与压强的关系 图4表示常温下,几种难溶氢氧化物的饱和溶液中金属离子浓度的负对数与溶液PH的关系,则在pH = 7的溶液中,Fe3+、Al3+、Fe2+能大量共存
 3C(g)+D(s)的影响,且P2 > PI 图乙表示25℃时,用0.1 mol/L盐酸滴定20 mL 0.1 mol/L NaOH溶液, 溶液的pH随加入盐酸体积的变化 依据图丙,若除去CuSO4溶液中的Fe3+,可向溶液中加入适量CuO, 调节pH≈4 图丁中开关K.置于A.或B.处均可以减缓铁的腐蚀
3C(g)+D(s)的影响,且P2 > PI 图乙表示25℃时,用0.1 mol/L盐酸滴定20 mL 0.1 mol/L NaOH溶液, 溶液的pH随加入盐酸体积的变化 依据图丙,若除去CuSO4溶液中的Fe3+,可向溶液中加入适量CuO, 调节pH≈4 图丁中开关K.置于A.或B.处均可以减缓铁的腐蚀
 3C(g)+D(s)的影响,乙比甲的压强大 图③中曲线表示反应3A(g) + B(g)
3C(g)+D(s)的影响,乙比甲的压强大 图③中曲线表示反应3A(g) + B(g) 2C(g)△H<0,正、逆反应的平衡常数K.随温度的变化 据图④,若要除去CuSO4溶液中的Fe3+,可加入NaOH溶液至pH在4左右
2C(g)△H<0,正、逆反应的平衡常数K.随温度的变化 据图④,若要除去CuSO4溶液中的Fe3+,可加入NaOH溶液至pH在4左右

 2SO3 各成分的物质的量变化,t2时刻改变的条件可能是缩小容器体积 图Ⅲ表示某明矾溶液中加入Ba(OH)2溶液,沉淀的质量与加入Ba(OH)2溶液体积的关系,在加入20 mL Ba(OH)2 溶液时铝离子恰好沉淀完全 图Ⅳ表示pH相同的盐酸与醋酸中分别加入水后溶液pH的变化,其中曲线a对应的是盐酸
2SO3 各成分的物质的量变化,t2时刻改变的条件可能是缩小容器体积 图Ⅲ表示某明矾溶液中加入Ba(OH)2溶液,沉淀的质量与加入Ba(OH)2溶液体积的关系,在加入20 mL Ba(OH)2 溶液时铝离子恰好沉淀完全 图Ⅳ表示pH相同的盐酸与醋酸中分别加入水后溶液pH的变化,其中曲线a对应的是盐酸
 2SO3 ΔH<0各成分的物质的量变化,t2时刻改变的条件可能是加压或降低温度 图III表示某明矾溶液中加入Ba(OH)2溶液,沉淀的质量与加入Ba(OH)2溶液体积的关系,在加入20mlBa(OH)2溶液时,沉淀是Al(OH)3和BaSO4的混合物 图IV表示向一定体积含等浓度NH4Cl、AlCl3、MgCl2混合溶液中逐渐加入NaOH溶液至过量的过程中,生成沉淀的质量与加入NaOH溶液的体积之间的关系
2SO3 ΔH<0各成分的物质的量变化,t2时刻改变的条件可能是加压或降低温度 图III表示某明矾溶液中加入Ba(OH)2溶液,沉淀的质量与加入Ba(OH)2溶液体积的关系,在加入20mlBa(OH)2溶液时,沉淀是Al(OH)3和BaSO4的混合物 图IV表示向一定体积含等浓度NH4Cl、AlCl3、MgCl2混合溶液中逐渐加入NaOH溶液至过量的过程中,生成沉淀的质量与加入NaOH溶液的体积之间的关系
 2C(g) ΔH > 0,正、逆反应的平衡常数K.随温度的变化 图③表示压强对可逆反应2A(g)+2B(g)
2C(g) ΔH > 0,正、逆反应的平衡常数K.随温度的变化 图③表示压强对可逆反应2A(g)+2B(g)  3C(g)+D(s)的影响,乙的压强比甲的压强大 据图④若除去CuSO4溶液中的Fe3+可向溶液中加入适量CuO至pH在4左右。
3C(g)+D(s)的影响,乙的压强比甲的压强大 据图④若除去CuSO4溶液中的Fe3+可向溶液中加入适量CuO至pH在4左右。