你可能感兴趣的试题
AgCl在饱和NaCl溶液中的 K.SP 比在纯水中的 K.SP 小 向AgCl的悬浊液中加入NaBr溶液,白色沉淀转化为淡黄色,说明 K.SP (AgCl) < K.SP (AgI) 将0.001 mol・L- 1 的AgNO3 溶液滴入0.001 mol・L- 1 的KCl和0.001 mol・L- 1 的K2CrO4 溶液中先产生Ag2CrO4 沉淀 向AgCl的悬浊液中滴加浓氨水,沉淀溶解,说明AgCl的溶解平衡向右移动
0.1 mol•L-1NaHCO3溶液: K+、Fe3+、Cl-、NO3- 使甲基橙变红色的溶液:NH4+、Cu2+、ClO-、Na+ 常温下由水电离出的c(H+)=1×10-13mol·L-1的溶液中:Mg2+、Na+、SO32-、NO3- 常温下在c(H+)=1×10-13mol·L-1的溶液中: Na+、K+、SO42-、CO32-
某温度时的混合溶液中c(H+)= mol·L-1,说明该溶液呈中性(K.W为该温度时水的离子积常数) 常温下,由水电离出的c(H+)=10-12mol·L-1的溶液的pH可能为2或12 已知K.sp(AgCl)=1.56×10-10,K.sp(Ag2CrO4)=9.0×10-12,向含有Cl-、CrO
mol·L-1,说明该溶液呈中性(K.W为该温度时水的离子积常数) 常温下,由水电离出的c(H+)=10-12mol·L-1的溶液的pH可能为2或12 已知K.sp(AgCl)=1.56×10-10,K.sp(Ag2CrO4)=9.0×10-12,向含有Cl-、CrO 且浓度均为0.010 mol·L-1溶液中逐滴加入0.010 mol·L-1的AgNO3溶液时,CrO
且浓度均为0.010 mol·L-1溶液中逐滴加入0.010 mol·L-1的AgNO3溶液时,CrO 先产生沉淀 常温下pH=7的CH3COOH和CH3COONa混合溶液中,c(Na+)=c(CH3COO-)
先产生沉淀 常温下pH=7的CH3COOH和CH3COONa混合溶液中,c(Na+)=c(CH3COO-)
某温度时的混合溶液中c(H+)=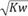 mol·L-1,说明该溶液呈中性(KW为该温度时水的离子积常数) 常温下,由水电离出的c(H+)=10-12mol·L-1的溶液的pH可能为2或12 已知Ksp(AgCl)=1.56×10-10,Ksp(Ag2CrO4)=9.0×10-12,向含有Cl-、CrO42-且浓度均为0.010 mol·L-1溶液中逐滴加入0.010 mol·L-1的AgNO3溶液时,CrO42-先产生沉淀 常温下pH=7的CH3COOH和CH3COONa混合溶液中,c(Na+)=c(CH3COO-)
mol·L-1,说明该溶液呈中性(KW为该温度时水的离子积常数) 常温下,由水电离出的c(H+)=10-12mol·L-1的溶液的pH可能为2或12 已知Ksp(AgCl)=1.56×10-10,Ksp(Ag2CrO4)=9.0×10-12,向含有Cl-、CrO42-且浓度均为0.010 mol·L-1溶液中逐滴加入0.010 mol·L-1的AgNO3溶液时,CrO42-先产生沉淀 常温下pH=7的CH3COOH和CH3COONa混合溶液中,c(Na+)=c(CH3COO-)
等体积混合浓度均为0.2 mol•L-1的AgNO3溶液和CH3COONa溶液一定不产生CH3COOAg沉淀 将0.001 mol•L-1的AgNO3溶液滴入0.001 mol•L-1的KCl和0.001 mol•L-1的K2CrO4溶液中先产生Ag2CrO4沉淀 在Mg2+为0.12 mol•L-1的溶液中要产生Mg(OH)2沉淀,溶液的pH至少要控制在9以上 向1ml 0.1 mol•L-1AgNO3溶液中加入2滴0.1 mol•L-1NaCl溶液产生白色沉淀,再滴加2滴0.1 mol•L-1KI溶液,又产生黄色沉淀,证明相同温度下Ksp(AgCl)大于Ksp(AgI)
浓度均为2×10-5mol/L的AgNO3溶液和NaCl溶液等体积混合,有白色沉淀生成 将0.1mol/L的AgNO3溶液滴入浓度均为0.001mol/L的KCl和K2CrO4混合溶液中,先产生AgCl沉淀 c(Mg2+)为0.11mol/L的溶液中要产生Mg(OH)2沉淀,溶液的pH要控制在9以上 其他条件不变时,向饱和Ag2CrO4水溶液中加入少量K2CrO4固体,溶液中c(Ag+)减少
温度升高,K.sp(AgCl)不变 向饱和AgCl水溶液中加入NaCl溶液,K.sp(AgCl)变大 常温下,将0.001 mol•L.-1 AgNO3溶液滴入0.001 mol·L-1 KCl和 0.001 mol·L-1 K2CrO4溶液先产生Ag2CrO4沉淀 在Mg 2+为0.12 mol•L.-1的溶液中要产生Mg(OH)2沉淀,应控制溶液的pH>9
某温度时的混合溶液中c(H+)= mol·L.-1,说明该溶液呈中性[. 常温下,由水电离出的c(H+)=10-12mol·L.-1的溶液的pH可能为2或12 已知K.sp(AgCl)=1.56×10-10,K.sp(Ag2CrO4)=9.0×10-12,向含有Cl-、CrO42-且浓度均为0.010 mol·L.-1溶液中逐滴加入0.010 mol·L.-1的AgNO3溶液时,CrO42-先产生沉淀 常温下pH=7的CH3COOH和CH3COONa混合溶液中,c(Na+)=c(CH3COO-)
mol·L.-1,说明该溶液呈中性[. 常温下,由水电离出的c(H+)=10-12mol·L.-1的溶液的pH可能为2或12 已知K.sp(AgCl)=1.56×10-10,K.sp(Ag2CrO4)=9.0×10-12,向含有Cl-、CrO42-且浓度均为0.010 mol·L.-1溶液中逐滴加入0.010 mol·L.-1的AgNO3溶液时,CrO42-先产生沉淀 常温下pH=7的CH3COOH和CH3COONa混合溶液中,c(Na+)=c(CH3COO-)
常温下,pH=5的CH3COOH溶液和pH=5的NH4Cl溶液中,水的电离程度相同 常温下,将pH =10的氨水稀释后,溶液中所有离子浓度都减小 常温下,0.1 mol/L Na2S溶液中存在:c(OH-) = c(H+) + c(HS-) + c(H2S) 常温下,pH为1的0.1 mol/L HA溶液与0.1 mol/L NaOH溶液恰好完全反应时,溶液中一定存在: c (Na+) = c(A-) > c(OH-) = c(H+)
某溫度时的混合溶液中C.(H+) = mol·L-1,说明该溶液呈中性(KW为该温度时水的离子积常数) 常温下,由水电离出的c(H+)=10-12mol·L-1的溶液的PH可能为2或12 已知Ksp(AgCl)=1.56×10-10。Ksp(Ag2CrO4)=9.0×10-12,向含有Cl-、CrO42-且浓度均为0.010mol·L-1溶液中逐滴加入0.010mol·L-1的AgNO3溶液时,Cl-先产生沉淀 常温下PH=7的CH3COOH和CH3COONa混合溶液中,c(Na+)=c(CH3COO-)+c(CH3COOH)
mol·L-1,说明该溶液呈中性(KW为该温度时水的离子积常数) 常温下,由水电离出的c(H+)=10-12mol·L-1的溶液的PH可能为2或12 已知Ksp(AgCl)=1.56×10-10。Ksp(Ag2CrO4)=9.0×10-12,向含有Cl-、CrO42-且浓度均为0.010mol·L-1溶液中逐滴加入0.010mol·L-1的AgNO3溶液时,Cl-先产生沉淀 常温下PH=7的CH3COOH和CH3COONa混合溶液中,c(Na+)=c(CH3COO-)+c(CH3COOH)
AgCl在饱和NaCl溶液中的 K.SP 比在纯水中的 K.SP 小 向AgCl的悬浊液中加入NaBr溶液,白色沉淀转化为淡黄色,说明 K.SP (AgCl) < K.SP (AgI) 将0.001 mol·L- 1 的AgNO3 溶液滴入0.001 mol·L- 1 的KCl和0.001 mol·L- 1 的K2CrO4 溶液中先产生Ag2CrO4 沉淀 向AgCl的悬浊液中滴加浓氨水,沉淀溶解,说明AgCl的溶解平衡向右移动
向氯化银的悬浊液中加入氯化钠溶液,Ksp(AgCl)减小 饱和AgCl溶液与饱和Ag2CrO4溶液相比,前者的c(Ag+)大 若向0.0008mol·L-1的K2CrO4溶液中加入等体积0.002 mol·L-1的AgNO3 溶液,则CrO42 --完全沉淀 若将0.001mol·L-1AgNO3 溶液滴入浓度均为0.001 mol·L-1的KCl和K2CrO4混合溶液中,则先产生AgCl沉淀
AgCl在饱和NaCl溶液中的K.sp比在纯水中的小 向AgCl的悬浊液中加入NaBr溶液,白色沉淀转化为淡黄色, 说明K.sp(AgCl)<K.sp(AgBr) 将0.0001 mol·L-1 AgNO3溶液分别滴入0.0001 mol·L-1的KCl和0.0001 mol·L-1的K2CrO4溶液中先产生Ag2CrO4沉淀 向AgCl的悬浊液中滴加浓氨水,沉淀溶解,说明AgCl的溶解平衡向右移动
在t℃时,Ag2CrO4的K.sp为1×10﹣11 在饱和溶液中加入K.2CrO4(s)可使溶液由Y.点到Z.点 在t℃,Ag2CrO4(s)+2Cl﹣(aq)⇌2AgCl(s)+CrO
 (aq)平衡常数K=6.25×107 在t℃时,以0.001 mol•L﹣1 AgNO3溶液滴定20 mL 0.001 mol•L﹣1 KCl和0.001 mol•L﹣1的K.2CrO4的混合溶液,CrO
(aq)平衡常数K=6.25×107 在t℃时,以0.001 mol•L﹣1 AgNO3溶液滴定20 mL 0.001 mol•L﹣1 KCl和0.001 mol•L﹣1的K.2CrO4的混合溶液,CrO
 先沉淀
先沉淀
已知25℃时NH4CN溶液显碱性,则25℃时的电离平衡常数K(NH3·H2O)>K(HCN) 由水电离出的c(H+)=10-12mol·L-1的溶液中:Na+、Ba2+、HCO3-、Cl-可以大量共存 已知K.sp(AgCl)=1.56×10-10,K.sp(Ag2CrO4)=9.0×10-12。向含有Cl-、CrO42-且浓度均为0.010 mol·L-1溶液中逐滴加入0.010 mol·L-1的AgNO3溶液时,CrO42-先产生沉淀 常温下pH=7的CH3COOH和NaOH混合溶液中,c(Na+)>c(CH3COO-)

 mol·L-1,说明该溶液呈中性(K.W为该温度时水的离子积常数) 常温下,由水电离出的c(H+)=10-12mol·L-1的溶液的pH可能为2或12 已知K.sp(AgCl)=1.56×10-10,K.sp(Ag2CrO4)=9.0×10-12,向含有Cl-、CrO
mol·L-1,说明该溶液呈中性(K.W为该温度时水的离子积常数) 常温下,由水电离出的c(H+)=10-12mol·L-1的溶液的pH可能为2或12 已知K.sp(AgCl)=1.56×10-10,K.sp(Ag2CrO4)=9.0×10-12,向含有Cl-、CrO 且浓度均为0.010 mol·L-1溶液中逐滴加入0.010 mol·L-1的AgNO3溶液时,CrO
且浓度均为0.010 mol·L-1溶液中逐滴加入0.010 mol·L-1的AgNO3溶液时,CrO 先产生沉淀 常温下pH=7的CH3COOH和CH3COONa混合溶液中,c(Na+)=c(CH3COO-)
先产生沉淀 常温下pH=7的CH3COOH和CH3COONa混合溶液中,c(Na+)=c(CH3COO-)
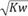 mol·L-1,说明该溶液呈中性(KW为该温度时水的离子积常数) 常温下,由水电离出的c(H+)=10-12mol·L-1的溶液的pH可能为2或12 已知Ksp(AgCl)=1.56×10-10,Ksp(Ag2CrO4)=9.0×10-12,向含有Cl-、CrO42-且浓度均为0.010 mol·L-1溶液中逐滴加入0.010 mol·L-1的AgNO3溶液时,CrO42-先产生沉淀 常温下pH=7的CH3COOH和CH3COONa混合溶液中,c(Na+)=c(CH3COO-)
mol·L-1,说明该溶液呈中性(KW为该温度时水的离子积常数) 常温下,由水电离出的c(H+)=10-12mol·L-1的溶液的pH可能为2或12 已知Ksp(AgCl)=1.56×10-10,Ksp(Ag2CrO4)=9.0×10-12,向含有Cl-、CrO42-且浓度均为0.010 mol·L-1溶液中逐滴加入0.010 mol·L-1的AgNO3溶液时,CrO42-先产生沉淀 常温下pH=7的CH3COOH和CH3COONa混合溶液中,c(Na+)=c(CH3COO-)
 mol·L.-1,说明该溶液呈中性[. 常温下,由水电离出的c(H+)=10-12mol·L.-1的溶液的pH可能为2或12 已知K.sp(AgCl)=1.56×10-10,K.sp(Ag2CrO4)=9.0×10-12,向含有Cl-、CrO42-且浓度均为0.010 mol·L.-1溶液中逐滴加入0.010 mol·L.-1的AgNO3溶液时,CrO42-先产生沉淀 常温下pH=7的CH3COOH和CH3COONa混合溶液中,c(Na+)=c(CH3COO-)
mol·L.-1,说明该溶液呈中性[. 常温下,由水电离出的c(H+)=10-12mol·L.-1的溶液的pH可能为2或12 已知K.sp(AgCl)=1.56×10-10,K.sp(Ag2CrO4)=9.0×10-12,向含有Cl-、CrO42-且浓度均为0.010 mol·L.-1溶液中逐滴加入0.010 mol·L.-1的AgNO3溶液时,CrO42-先产生沉淀 常温下pH=7的CH3COOH和CH3COONa混合溶液中,c(Na+)=c(CH3COO-)
 mol·L-1,说明该溶液呈中性(KW为该温度时水的离子积常数) 常温下,由水电离出的c(H+)=10-12mol·L-1的溶液的PH可能为2或12 已知Ksp(AgCl)=1.56×10-10。Ksp(Ag2CrO4)=9.0×10-12,向含有Cl-、CrO42-且浓度均为0.010mol·L-1溶液中逐滴加入0.010mol·L-1的AgNO3溶液时,Cl-先产生沉淀 常温下PH=7的CH3COOH和CH3COONa混合溶液中,c(Na+)=c(CH3COO-)+c(CH3COOH)
mol·L-1,说明该溶液呈中性(KW为该温度时水的离子积常数) 常温下,由水电离出的c(H+)=10-12mol·L-1的溶液的PH可能为2或12 已知Ksp(AgCl)=1.56×10-10。Ksp(Ag2CrO4)=9.0×10-12,向含有Cl-、CrO42-且浓度均为0.010mol·L-1溶液中逐滴加入0.010mol·L-1的AgNO3溶液时,Cl-先产生沉淀 常温下PH=7的CH3COOH和CH3COONa混合溶液中,c(Na+)=c(CH3COO-)+c(CH3COOH)

 (aq)平衡常数K=6.25×107 在t℃时,以0.001 mol•L﹣1 AgNO3溶液滴定20 mL 0.001 mol•L﹣1 KCl和0.001 mol•L﹣1的K.2CrO4的混合溶液,CrO
(aq)平衡常数K=6.25×107 在t℃时,以0.001 mol•L﹣1 AgNO3溶液滴定20 mL 0.001 mol•L﹣1 KCl和0.001 mol•L﹣1的K.2CrO4的混合溶液,CrO
 先沉淀
先沉淀