你可能感兴趣的试题
H2燃烧生成1 mol H2O(g)时,放出241.8 kJ的热量 O2前面的 表示参加反应的O2的分子数目
表示参加反应的O2的分子数目
吸热88kJ 吸热2.44kJ 放热44kJ 吸热44kJ
试管a中的气体是H2 试管b中的气体能使带火星的木条复燃 电解水产生的H2和O2的质量比为2∶1 电解水反应的化学方程式为2H2O 2H2↑+O2↑
2H2↑+O2↑
Fe + CuSO4 == FeSO4 + Cu 2H2O + O2 点燃=== 2H2O CO2 + 2NaOH == Na2CO3 + H2O NaOH + HCl == NaCl + H2O
H2燃烧生成1mol H2O(g)时,放出241.8 kJ的热量 O2前面的 表示参加反应的O2的分子数目 298K时,lmolH2完全燃烧生成稳定的氧化物时放出的热量为285.8 kJ 1mol液态水变成水蒸气时吸收44 kJ的热量
表示参加反应的O2的分子数目 298K时,lmolH2完全燃烧生成稳定的氧化物时放出的热量为285.8 kJ 1mol液态水变成水蒸气时吸收44 kJ的热量
H2O(g)=H2(g)+1/2 O2(g) ΔH=+242 kJ/mol 2 H2(g)+O2(g)=2 H2O(g) ΔH=-484 kJ/mol H2(g)+1/2 O2(g)=H2O(g) ΔH=+242 kJ/mol 2 H2(g)+O2(g)=2 H2O(g) ΔH=+484 kJ/mol
由H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1,则向含0.1 mol HCl的盐酸中加入4.0 gNaOH固体,放出热量等于5.73 kJ 等量H2在O2中完全燃烧生成H2O(g)与生成H2O(l),放出的能量相同 同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的ΔH不同 氢气的燃烧热为285.8 kJ·mol-1,则水分解的热化学方程式为:2H2O(l)=2H2(g) + O2(g) ΔH=+ 571.6 kJ·mol-1
试管a中的气体是H2 试管b中的气体能使带火星的木条复燃 产生的H2和O2的质量比为2 : 1 发生反应的化学方程式为2H2O通电2H2↑+ O2↑
由反应①、②可知如图所示的热化学方程式为CO(g)+H2O(g)==== CO2(g)+H2(g)ΔH = -41.2 kJ·mol-1 H2的燃烧热为241.8 kJ·mol-1 H2(g)转变成H2O(g)的化学反应一定要释放能量 根据②推知反应H2(g)+1/2O2(g)==== H2O(l)ΔH > -241.8 kJ·mol-1
1∶16∶9 2∶16∶9 1∶8∶9 2∶1∶2
2H2(g) + O2(g)= 2H2O(g) △H1 ; 2H2(g) + O2(g) = 2H2O(l) △H2 S(g) + O2(g) =SO2(g) △H1 ; S(s) + O2(g) = SO2(g) △H2 CO(g) + 1/2 O2(g) = CO2(g) △H1 ;2CO(g) + O2(g) = 2CO2(g) △H2 C.(s)+H2O(g)=CO(g)+H2(g) △H1 ;CaO(s)+H2O(l)===Ca(OH)2(s) △H2
9:1:16 9:1:8 9:2:8 10:1:9

 表示参加反应的O2的分子数目
表示参加反应的O2的分子数目
 2H2↑+O2↑
2H2↑+O2↑ 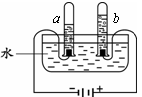
 表示参加反应的O2的分子数目 298K时,lmolH2完全燃烧生成稳定的氧化物时放出的热量为285.8 kJ 1mol液态水变成水蒸气时吸收44 kJ的热量
表示参加反应的O2的分子数目 298K时,lmolH2完全燃烧生成稳定的氧化物时放出的热量为285.8 kJ 1mol液态水变成水蒸气时吸收44 kJ的热量