你可能感兴趣的试题
-69.4 kJ·mol-1 + 45.2 kJ·mol-1 .+69.4 kJ·mol-1 - 45.2 kJ·mol-1
HF的电离方程式及热效应:HF(aq)===H+(aq)+F.-(aq) ΔH>0 在氢氧化钠溶液与盐酸的反应中,盐酸量一定,氢氧化钠溶液量越多,中和热越大 ΔH2=-57.3 kJ·mol-1是强酸和强碱在稀溶液中反应生成可溶盐的中和热 稀硫酸与稀氢氧化钡溶液反应的热化学方程式为: H2SO4(aq)+Ba(OH)2(aq)===BaSO4(s)+ 2H2O(l)ΔH.=-114.6 kJ·mol-1
HNO3(aq)+KOH(aq)=H2O(l) +KNO3(aq) ΔH > -57.3kJ/mol. HNO3(aq)+NH3 ·H2O(aq)=H2O(l) +KNO3(aq) ΔH < -57.3kJ/mol. CH3COOH(aq)+KOH(aq)=H2O(l) + CH3COOK(aq) ΔH< -57.3kJ/mol. CH3COOH(aq)+ NH3 ·H2O(aq)=H2O(l) + CH3COONH4(aq)
ΔH > -57.3kJ/mol.
ΔH.1=ΔH.2=-57.3 ΔH.1>ΔH.2=-57.3 ΔH.1<ΔH.2<-57.3 无法比较
中和热一定是强酸跟强碱反应放出的热量 1 mol酸与1 mol碱完全反应放出的热量是中和热 在稀溶液中,酸与碱发生中和反应生成1 mol H2O时的反应热叫做中和热 表示中和热的离子方程式为:H+(aq)+OH-(aq)=H2O(l); △H=57.3KJ/mol
稀硫酸与稀NaOH溶液的中和热为57.3 kJ/mol ①的反应热为221 kJ/mol 稀硫酸与稀NaOH溶液反应的中和热为-57.3 kJ/mol 稀醋酸与稀NaOH溶液反应生成1 mol水,放出57.3 kJ热量
Q.1=Q.2=Q.3 Q.2>Q.1>Q.3 Q.2>Q.3>Q.1 Q.2=Q.3>Q.1
-69.4 kJ·mol-1 -45.2 kJ·mol-1 +69.4 kJ·mol-1 +45.2 kJ·mol-1
强酸跟强碱的反应热一定是中和热 1molC完全燃烧放热383.3kJ,其热化学方程为: +O2═CO2 △H=﹣383.3kJ•mol﹣1 C.在稀溶液中,强酸与强碱发生中和反应生成1molH.2O.时的反应热叫做中和热 表示中和热的离子方程式为:H.+(aq)+OH﹣(aq)═H.2O.(l);△H=57.3KJ•mol﹣1
中和热一定是强酸跟强碱反应放出的热量 1 mol酸与1 mol碱完全反应放出的热量是中和热 在稀溶液中,酸与碱发生中和反应生成1 mol H2O(l)时的反应热叫做中和热 测定中和热时可用稀硫酸和稀Ba(OH)2溶液
-69.4 kJ·mol-1 -45.2 kJ·mol-1 +69.4 kJ·mol-1 +45.2 kJ·mol-1
烧杯间填满金属碎末 大烧杯上不盖硬纸板 用相同浓度和体积的氨水代替NaOH溶液进行实验 用浓硫酸代替稀盐酸
-69.4 kJ/mol -45.2 kJ/mol +69.4 kJ/mol +45.2 kJ/mol
+45.2 kJ·mol-1 -45.2 kJ·mol-1 +69.4 kJ·mol-1 -69.4 kJ·mol-1
碳的燃烧热大于110.5 kJ/mol 右图可表示①的反应过程和能量关系 稀硫酸与稀NaOH溶液反应的中和热为57.3 kJ/mol 稀醋酸与稀NaOH溶液反应生成1 mol水,放出57.3 kJ 热量
-69.4 kJ/mol -45.2kJ/mol +69.4 kJ/mol +45.2 kJ/mol
-69.4 kJ·mol-1 -45.2 kJ·mol-1 +69.4 kJ·mol-1 +45.2 kJ·mol-1
KOH(aq)+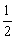 H2SO4(aq)
H2SO4(aq)
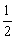 K2SO4(aq)+H2O(l) ΔH.=-57.3 kJ·mol-1 NaOH(aq)+HCl(aq)
K2SO4(aq)+H2O(l) ΔH.=-57.3 kJ·mol-1 NaOH(aq)+HCl(aq)  NaCl(aq)+H2O(l) ΔH.=+57.3 kJ·mol-1 H2SO4和Ca(OH)2反应的中和热为ΔH.=2×(-57.3) kJ·mol-1 稀醋酸与稀NaOH溶液反应生成1 mol水,放出57.3 kJ热量
NaCl(aq)+H2O(l) ΔH.=+57.3 kJ·mol-1 H2SO4和Ca(OH)2反应的中和热为ΔH.=2×(-57.3) kJ·mol-1 稀醋酸与稀NaOH溶液反应生成1 mol水,放出57.3 kJ热量

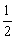 H2SO4(aq)
H2SO4(aq)
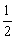 K2SO4(aq)+H2O(l) ΔH.=-57.3 kJ·mol-1 NaOH(aq)+HCl(aq)
K2SO4(aq)+H2O(l) ΔH.=-57.3 kJ·mol-1 NaOH(aq)+HCl(aq)  NaCl(aq)+H2O(l) ΔH.=+57.3 kJ·mol-1 H2SO4和Ca(OH)2反应的中和热为ΔH.=2×(-57.3) kJ·mol-1 稀醋酸与稀NaOH溶液反应生成1 mol水,放出57.3 kJ热量
NaCl(aq)+H2O(l) ΔH.=+57.3 kJ·mol-1 H2SO4和Ca(OH)2反应的中和热为ΔH.=2×(-57.3) kJ·mol-1 稀醋酸与稀NaOH溶液反应生成1 mol水,放出57.3 kJ热量