你可能感兴趣的试题
密闭容器中反应达到平衡,t0时改变某一条件有如图变化所示,则改变的条件一定是加入催化剂 反应达到平衡时,外界条件对平衡影响关系如图所示,则正反应为放热反应,且a>b
反应达到平衡时,外界条件对平衡影响关系如图所示,则正反应为放热反应,且a>b 物质的百分含量和温度关系如图所示,则该反应的正反应为吸热反应
物质的百分含量和温度关系如图所示,则该反应的正反应为吸热反应 反应速率和反应条件变化关系如图所示,则该反应的正反应为放热反应,A.B.C.是气体、D.为固体或液体
反应速率和反应条件变化关系如图所示,则该反应的正反应为放热反应,A.B.C.是气体、D.为固体或液体
图甲中t2时刻发生改变的条件是增大反应物的浓度 图甲中t2时刻发生改变的条件可能是增大压强 图乙中t2时刻发生改变的条件是升高温度 图乙中t2时刻发生改变的条件是从体系中分离出水蒸气
若X.是固体,则t1时一定是增大了容器的压强 若X.是气体,则t2时可能是增大了容器的压强 若X.是固体,则t1时可能是增大了X.的质量 t2时不可能是减小容器压强;若采用了降温措施, 则该反应的正反应方向△H.<0
密闭容器中反应达到平衡,t0时改变某一条件(图A.),则改变的条件一定是加入催化剂 反应达平衡时,外界条件对平衡影响关系(图B.),则正反应为放热反应,且a>b 物质的百分含量和温度关系(图C.),则该反应的正反应为吸热反应 反应速率和反应条件变化关系(图D.),则该反应的正反应为放热反应,A.B.C.是气体、D.为固体或液体
该反应为化合反应 丙可能为该反应的催化剂 该反应中,乙、丁的质量变化之比为7:5 该反应中,甲、乙的质量变化之比为1:4
(1)对应的是:在t1时恒压条件下,通入NH3 (2)对应的是:氨气在恒容不同温度下的百分含量 (3)对应的是:在恒容条件下,反应速率与温度的关系 (4)对应的是:N2转化率与温度(T1>T2)、压强的关系
若容器内气体的密度不再发生变化,则说明反应达到平衡状态 若t1=20 s,则从t0~t1内的平均反应速率v(NH3)=0.01 mol·L-1·s-1 图2中,t2时改变的条件是降低温度,t3时改变的条件是增大压强 若t2时,再向容器中加入1.4 mol NH3、0.8 mol H2,则平衡将正向移动
(s)+2B(g)  2C(g) ΔH<0,反应过程中 C.的物质的量随时间变化的关系如图1;反应达平衡后在t1、t2、t3、t4时分别都只改变了一种条件,逆反应速率随时间变化的关系如图2。下列有关说法正确的是( )
2C(g) ΔH<0,反应过程中 C.的物质的量随时间变化的关系如图1;反应达平衡后在t1、t2、t3、t4时分别都只改变了一种条件,逆反应速率随时间变化的关系如图2。下列有关说法正确的是( )  A.反应开始2 min内,vB.=0.1 mol/(L·min) B.t1时改变的条件可能是升高温度 t3时改变的条件可能是加压,此时cB.不变 t4时可能是使用了催化剂,此时cB.不变
A.反应开始2 min内,vB.=0.1 mol/(L·min) B.t1时改变的条件可能是升高温度 t3时改变的条件可能是加压,此时cB.不变 t4时可能是使用了催化剂,此时cB.不变
密闭容器中反应达到平衡,t0时改变某一条件有如图变化所示,则改变的条件一定是加入催化剂 反应达到平衡时,外界条件对平衡影响关系如图所示,则正反应为放热反应,且a>b 物质的百分含量和温度关系如图所示,则该反应的正反应为吸热反应 反应速率和反应条件变化关系如图所示,则该反应的正反应为放热反应,A.B.C.是气体、D.为固体或液体
在t1时刻,甲和乙的速度相同 在t1时刻,甲和乙的速度大小相同,方向相反 在t2时刻,甲和乙的速度方向相同,加速度方向相反 在t2时刻,甲和乙的速度不相同,加速度方向相同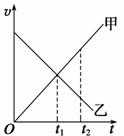
容器中发生的反应可表示为:3X(g)+Y(g) 2Z(g)
2Z(g)
反应进行前3min内,用X.表示的反应速率v(X)=0.1mol/(L·min)
若改变反应条件,使反应进程如图3所示,则改变的条件是使用催化剂 保持其他条件不变,升高温度,化学平衡向逆反应方向移动
若X.是固体,则t1时一定是增大了容器的压强 若X.是气体,则t2时可能是增大了容器的压强 若X.是固体,则t1时可能是增大了X.的质量 t2时不可能是减小容器压强;若采用了降温措施,则该反应的正反应方向△H.<0 
若X.是固体,则t1时一定是增大了容 器的压强 若X.是气体,则t2时可能是增大了容器的压强 若X.是固体,则t1时可能是增大了X.的质量 t2时不可能是减小容器压强;若采用了降温措施,则该反应的正反应方向△H.<0 
由图Ⅰ知,反应在T1、T3处达到平衡,且该反应的ΔH<0 由图Ⅱ知,反应在t6时刻,NH3体积分数最大 由图Ⅱ知,t3时采取了增大反应体系压强的措施 图Ⅲ表示在10L.容器、850℃时的反应,由图知,到4 min时,反应放出51.6 kJ的热量
图甲中t2时刻发生改变的条件是增大反应物的浓度 图甲中t2时刻发生改变的条件可能是增大压强 图乙中t2时刻发生改变的条件是升高温度 图乙中t2时刻发生改变的条件是从体系中分离出水蒸气
0~t1时间内火箭的加速度小于t1~t2时间内火箭的加速 在0~t2时间内火箭上升, t2~t3在时间内火箭下落 t3时刻火箭离地面最远 t3时刻火箭回到地面

 反应达到平衡时,外界条件对平衡影响关系如图所示,则正反应为放热反应,且a>b
反应达到平衡时,外界条件对平衡影响关系如图所示,则正反应为放热反应,且a>b 物质的百分含量和温度关系如图所示,则该反应的正反应为吸热反应
物质的百分含量和温度关系如图所示,则该反应的正反应为吸热反应 反应速率和反应条件变化关系如图所示,则该反应的正反应为放热反应,A.B.C.是气体、D.为固体或液体
反应速率和反应条件变化关系如图所示,则该反应的正反应为放热反应,A.B.C.是气体、D.为固体或液体
 2C(g) ΔH<0,反应过程中 C.的物质的量随时间变化的关系如图1;反应达平衡后在t1、t2、t3、t4时分别都只改变了一种条件,逆反应速率随时间变化的关系如图2。下列有关说法正确的是( )
2C(g) ΔH<0,反应过程中 C.的物质的量随时间变化的关系如图1;反应达平衡后在t1、t2、t3、t4时分别都只改变了一种条件,逆反应速率随时间变化的关系如图2。下列有关说法正确的是( )  A.反应开始2 min内,vB.=0.1 mol/(L·min) B.t1时改变的条件可能是升高温度 t3时改变的条件可能是加压,此时cB.不变 t4时可能是使用了催化剂,此时cB.不变
A.反应开始2 min内,vB.=0.1 mol/(L·min) B.t1时改变的条件可能是升高温度 t3时改变的条件可能是加压,此时cB.不变 t4时可能是使用了催化剂,此时cB.不变

 2Z(g)
2Z(g)
