你可能感兴趣的试题
HW是热稳定性最强的氢化物 Z.的最高正价为+6 原子序数X.>Y.>Z.>W. 纯净的X.与纯净的Z.反应生成XZ3
Y氢化物的沸点一定比X.氢化物的沸点高 Z的最高价氧化物的水化物酸性比W.的强 XZ2、XW4 与Na2O的化学键类型相同 根据元素周期律,可以推测存在TZ2 和TW4
最外层电子数=2的元素均为第ⅡA.族元素 在元素周期表中金属和非金属元素分界处可以找到半导体材料 短周期元素形成离子后,最外层电子都达到8电子稳定结构 同一主族的元素的原子,最外层电子数相同,化学性质完全相同
元素周期表有7个主族和8个副族 ⅣA.族的元素全部为非金属元素 元素周期表有7个周期 短周期指第1、2周期
﹣F.代表六种不同短周期元素.下列说法不正确的是( ) A. 原子序数E.<C A.D.同族 A.B.同周期 C.F.化学性质相似
—F.代表六种不同短周期元素。下列说法不正确的是( )  A.原子序数EA.D.同族 A.B.同周期 C.F.化学性质相似
A.原子序数EA.D.同族 A.B.同周期 C.F.化学性质相似
元素X.、Y.、Z.形成的化合物一定是离子化合物 X.元素和R.元素形成的化合物XR是18电子的分子 化合物QR3分子中各原子均满足8电子稳定结构 元素Z.的氧化物对应水化物一定为强酸
Z.的氧化物属于碱性氧化物 离子半径:Z>W 最高价氧化物对应水化物的碱性:Y>Z 气态氢化物的热稳定性:X>W
HW水溶液可以保存在玻璃瓶中 X.的单质与Z.的单质反应生成XZ3 Z.的最高正价为+6 原子序数X>Y>W>Z
X.元素可形成六种氧化物 Y.元素的最高价氧化物的水化物是含氧酸中酸性最强的 X.元素的非金属性比Y.元素非金属性强 四种元素中,原子半径最小的元素是X.
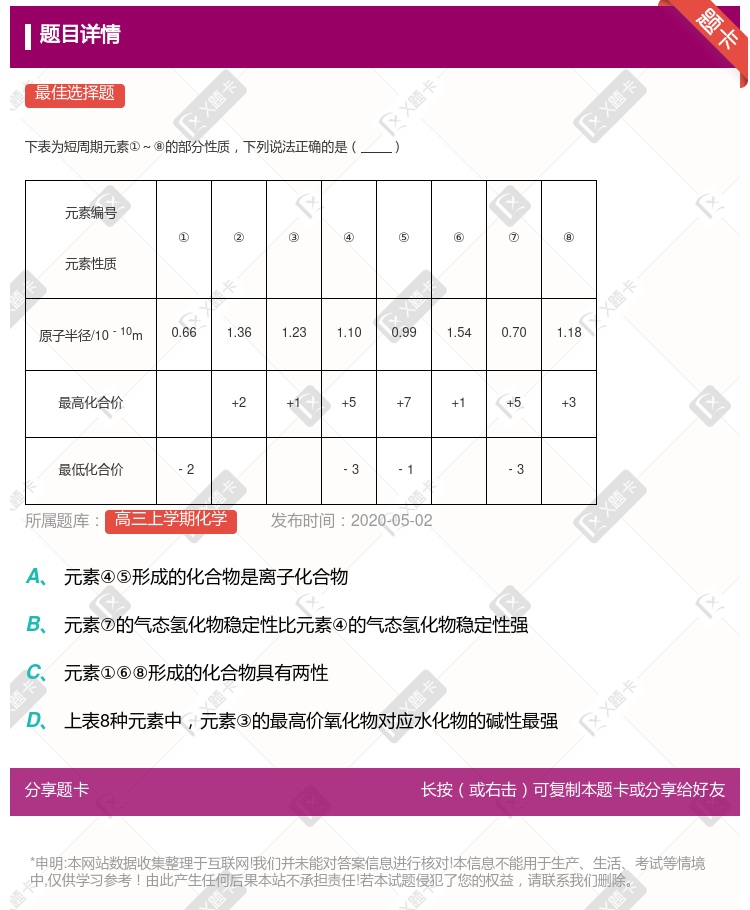
⑧号元素为Al ②、③处于同一周期 上述八种元素最高价氧化物对应的水化物⑤号酸性最强 ④元素的气态氢化物沸点大于⑦元素的氢化物
最外层电子数等于2的元素均为第ⅡA.族元素 在元素周期表中金属和非金属元素分界处可以找到半导体材料 短周期元素形成离子后,最外层电子都达到了8电子稳定结构 同一主族的元素的原子,最外层电子数相同,化学性质完全相同
第一电离能:Y>Z. 离子半径:W>Z. X.、Y.形成的化合物XY4是离子化合物 工业上利用电解熔融Z.的氧化物生产Z.金属单质
在元素周期表中,主族元素所表示的是由长周期元素和短周期元素共同组成的纵行 同周期元素的性质相似 元素按原子序数增大的顺序排列 在表的末尾排列的元素组成的单质晶体都具有高沸点
气态氢化物的热稳定性:X>W 非金属性:Y W. W.在空气中充分燃烧所得产物,可用于杀菌消毒 金属Z.与少量NaOH溶液反应,生成两性氢氧化物
③和⑥、④和⑦分别处于同一主族 元素④处于第3周期ⅤA族 元素①与元素⑥形成的化合物中不可能存在共价键 元素⑧对应的最高价氧化物及其水化物都具有两性
处于元素周期表金属和非金属分界线附近的为过渡元素 第三周期主族元素的最高正化合价等于它的主族序数 短周期元素形成离子后,最外层都达到8电子稳定结构 最外层有2个电子的元素一定是金属元素
X.与Y.可以形成阴离子XY32- 元素R.的氧化物对应水化物一定为强酸 Z.的氢化物的沸点比T.的氢化物的沸点高 由X.形成的化合物QX和XR4,其晶体类型不相同
图甲横坐标为原子序数,纵坐标表示元素的最高正价 图甲横坐标为核电荷数,纵坐标表示元素的原子半径(单位:pm) 图乙横坐标为最高正价,纵坐标表示元素的原子半径(单位:pm) 图乙横坐标为最外层电子数,纵坐标表示元素的原子半径(单位:pm)
元素⑦位于第3周期VA族 元素①⑧形成的化合物具有两性 元素④⑤形成的化合物是离子化合物 元素③的最高价氧化物对应水化物碱性最强
 A.原子序数E
A.原子序数E