你可能感兴趣的试题
任何可逆反应都有一定的限度 对于反应2SO2(g)+O2(g) 2SO3(g)只有达到限度时才有2v(O2)=v(SO3) 对于反应2SO2(g)+O2(g)
2SO3(g)只有达到限度时才有2v(O2)=v(SO3) 对于反应2SO2(g)+O2(g) 2SO3(g)达到限度时,增大容器容积能减小正反应速率 化学反应达到限度时,正逆反应速率相等
2SO3(g)达到限度时,增大容器容积能减小正反应速率 化学反应达到限度时,正逆反应速率相等
新平衡体系中,SO2和O2物质的量之比仍为2∶1 平衡向正反应方向移动,原因是正反应速率增大,逆反应速率减小 新平衡体系与旧平衡体系比较,SO3的浓度肯定增大 若所采取的措施是缩小容器的容积,则新旧平衡中SO2和O2的转化率之比都是1∶1
增大容器容积 通入大量O2 移去部分SO3 降低体系温度
降压时,平衡常数减小 降压时,平衡常数增大 降温时,平衡常数增大 升温时,平衡常数增大
升高温度正反应加快,逆反应不变 升高温度正逆反应都加快 升高温度逆反应加快,正反应不变 升高温度逆反应加快,正反应减慢
降压时,平衡常数减小 升温时,平衡常数增大 降温时,平衡常数增大 降压时,平衡常数增大
催化剂V2O5不改变该反应的逆反应速率 增大反应体系的压强,反应速率一定增大 该反应是放热反应,降低温度将缩短反应达到平衡的时间 在t1、t2时刻,SO3(g)的浓度分别是c1,c2,则时间间隔t1~t2内,SO3(g)生成的平均速率为v=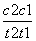
改变反应条件可以改变该反应的限度 增大压强,正逆反应速率都增大 达到平衡时,SO2、O2、SO3在容器中共存 达到平衡时,SO2与SO3的浓度相等
SO3的质量保持不变 SO2的百分含量保持不变 SO2和SO3的生成速率相等 SO2、O2、SO3的物质的量之比为2︰1︰2
降压时,平衡常数减小 升温时,平衡常数增大 降温时,平衡常数增大 降压时,平衡常数增大

 2SO3(g)只有达到限度时才有2v(O2)=v(SO3) 对于反应2SO2(g)+O2(g)
2SO3(g)只有达到限度时才有2v(O2)=v(SO3) 对于反应2SO2(g)+O2(g) 2SO3(g)达到限度时,增大容器容积能减小正反应速率 化学反应达到限度时,正逆反应速率相等
2SO3(g)达到限度时,增大容器容积能减小正反应速率 化学反应达到限度时,正逆反应速率相等