你可能感兴趣的试题
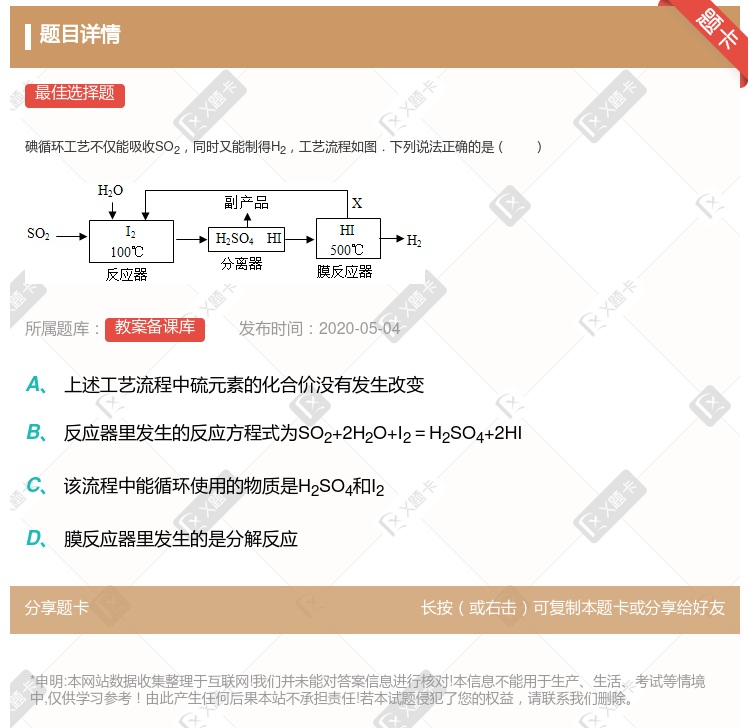
分离器中的物质分离操作为过滤 膜反应器中,增大压强有利于提高速率和HI的平衡转化率 该工艺中I2和HI的相互转化体现了“碘循环” 碘循环工艺的总反应为2SO2+4H2O+I2═H2+2H2SO4+2HI
过滤后所得沉淀表面一定含有的可溶性杂质是NH4NO3 冷却需在干燥的环境中进行,否则制得的高纯氧化钙中会混有杂质Ca(OH)2 制备高纯氧化钙的工艺流程中生成的沉淀是CaCO3 该工艺流程中可以循环使用的物质有NH4NO3和CO2
该流程中可得到化工产品H2SO4 该流程中化合价发生改变的元素为Fe和S. 流程中涉及到的反应之一为:Fe2(SO4)3+SO2+2H2O=2FeSO4+2H2SO4 该工艺流程中Fe2(SO4)3溶液可以循环使用
结构不同,工艺流程不同 结构不同,工艺流程不变 结构一样,工艺流程不同
分离器中的物质分离操作为过滤 膜反应器中,增大压强有利于提高速率和HI的平衡转化率 该工艺中I2和HI的相互转化体现了“碘循环” 碘循环工艺的总反应为2SO2+4H2O+I2 H2 + 2H2SO4 +2HI
H2 + 2H2SO4 +2HI
电解槽中也可以用铁电极代替石墨作为阳极 原电池中负极的电极反应为:SO2 + 2H2O +4e- = SO42- + 4H+ 该工艺流程用总反应的化学方程式表示为:SO2 + Br2+2H2O = 2HBr + H2SO4 该生产工艺的优点Br2被循环利用,原电池产生的电能可充分利用,还能获得清洁能源
上述工艺流程中碱元素的化合价没有发生改变
该碘循环工艺能减少SO2对环境的污染
该流程中能循环使用的物质是H2SO4和I2
该循环工艺过程的总反应方程式为SO2+2H2O  H2SO4+H2
H2SO4+H2
该流程中可得到化工产品 H2SO4 图中 FeSO4 → Fe2(SO4)3 的反应类型是复分解反应 该流程中化合价发生改变的元素为 Fe、S 和 O 图中吸收 SO2 的化学反应方程式为:Fe2(SO4)3 + SO2 + 2H2O == 2FeSO4 + 2H2SO4
分离器中的物质分离操作为过滤 膜反应器中,增大压强有利于提高速率和HI的平衡转化率[ 该工艺中I2和HI的相互转化体现了“碘循环” 碘循环工艺的总反应为2SO2+4H2O+ I2=H2+2H2SO4+2HI
该流程中可得到化工产品H2SO4 该流程中化合价发生改变的元素为Fe和S. 流程中涉及到的反应之一为:Fe(SO4)3+SO2+2H2O=2FeSO4+2H2SO4 该工艺流程中Fe2(SO4)3溶液可以循环使用
该工艺流程总反应可看作:2SO2+O2+2H2O.2H2SO4 也可以利用原电池原理来处理 SO2 废气 - +  溶液A.转化为溶液 B.发生反应的离子方程式为 2Fe3++SO2+2H2O 2Fe2++SO2 +4H 向溶液B.中滴加 KSCN 溶液,溶液一定不会变为红色
溶液A.转化为溶液 B.发生反应的离子方程式为 2Fe3++SO2+2H2O 2Fe2++SO2 +4H 向溶液B.中滴加 KSCN 溶液,溶液一定不会变为红色
 H2 + 2H2SO4 +2HI
H2 + 2H2SO4 +2HI
 H2SO4+H2
H2SO4+H2
 溶液A.转化为溶液 B.发生反应的离子方程式为 2Fe3++SO2+2H2O 2Fe2++SO2 +4H 向溶液B.中滴加 KSCN 溶液,溶液一定不会变为红色
溶液A.转化为溶液 B.发生反应的离子方程式为 2Fe3++SO2+2H2O 2Fe2++SO2 +4H 向溶液B.中滴加 KSCN 溶液,溶液一定不会变为红色