你可能感兴趣的试题
气体或 气体,重新达到平衡后,容器内A.的体积分数比平衡时 ( ) A.都增大 B.都减少 前者增大,后者减少 前者减少,后者增大
混合气体的密度不变时 混合气体的颜色不变化时 混合气体的总压强不变时 υ(HI) :υ(H2) :υ(I2)= 2 :1 :1时
升高温度,X.的体积分数减小 增大压强(缩小容器体积),Z.的浓度不变 保持容器体积不变,充入一定量的惰性气体,Y.的浓度不变 保持容器体积不变,充入一定量的Z.,X.的体积分数增大
升高温度,X.的体积分数减小 增大压强(缩小容器体积),Z.的浓度不变 保持容器体积不变,充入一定量的惰性气体,Y.的浓度减小 保持容器体积不变,充入一定量的Z.,X.的体积分数不变
,一定条件下,发生如下反应: 2A(g)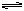 B(g)+xC(g),反应达到平衡时,测得容器内压强增大了p%,若此时A.的转化率为a%,下列关系正确的是: A.若x=1,则p>a 若x=2,则p<a 若x=3,则p=a 若x=4,则p≥a
B(g)+xC(g),反应达到平衡时,测得容器内压强增大了p%,若此时A.的转化率为a%,下列关系正确的是: A.若x=1,则p>a 若x=2,则p<a 若x=3,则p=a 若x=4,则p≥a
若x=1,则p>a 若x=2,则p 若x=3,则p=a 若x=1,则p=a
气体或 气体,重新达到平衡后,容器内A.的体积分数比原平衡时( ) A. 都增大B.前者增大 后者减小 都减小 前者减小 后者增大
气体或 气体,重新达到平衡后,容器内A.的体积分数比原平衡时 A.都增大B.都减小 前者增大后者减小 前者减少后者增大
,发生如下反应:2A(g)  (g)+ xC(g)。达平衡后,测得容器内的压强增大了p%,A.的平衡转化率为a%,则下列推断中正确的是 A.若x=1,则p>aB.若x=2,则p < a 若x=3,则p=a 若x=4,则p≥a
(g)+ xC(g)。达平衡后,测得容器内的压强增大了p%,A.的平衡转化率为a%,则下列推断中正确的是 A.若x=1,则p>aB.若x=2,则p < a 若x=3,则p=a 若x=4,则p≥a
保持容器体积不变,升高温度,混合气体的颜色逐渐变深 恒温,恒容,充入一定量氦气(不参与反应),则正反应速率和逆反应速率均增大 恒温,缓慢压缩容器,使容器体积恒定为0.2L,一定时间后,测得c(I2)=2.5mol/L 恒温、恒压,再通入2molHI气体,到达平衡状态后,HI转化率会提高
升高温度,X.的体积分数减小 增大压强(缩小容器体积),Z.的浓度不变 保持容器体积不变,充入一定量的惰性气体,Y.的浓度不变 保持容器体积不变,充入一定量的Z.,X.的体积分数增大
升高温度,X.的体积分数减小 增大压强(缩小容器体积),Z.的浓度不变 保持容器体积不变,充入一定量的惰性气体,Y.的浓度不变 保持容器体积不变,充入一定量的Z.,X.的体积分数增大
升高温度,X.的体积分数减小 增大压强(缩小容器体积),Z.的浓度不变 保持容器体积不变,充入一定量的惰性气体,Y.的浓度不变 保持容器体积不变,充入一定量的Z.,X.的体积分数增大
和足量 ,发生反应如下:2A(g)+B.(s)2C(g),测得相关数据如下,分析可知下列说法不正确的是 A.实验Ⅲ的化学平衡常数K.<1B.实验放出的热量关系为b=2a 实验Ⅲ在30 min达到平衡,30 min内A.的速率:vA.=0.002 5 mol·L.-1·min-1 当容器内气体密度不随时间而变化时上述反应达到平衡
升高温度,正反应速率增大 再通入一定量的NO2,反应速率减小 通入氮气,压强增大,化学反应速率增大 使用合适的催化剂,活化分子的百分数将增大,SO3的产率提高
气体或 气体,重新达到平衡后,容器内A.的体积分数比原平衡( )A.都增大B.都减小 前者增大后者减小 前者减小后者增大
升高温度,X的体积分数减小 增大压强(缩小容器体积),Z的浓度不变 保持容器体积不变,充入一定量的惰性气体,Y的浓度不变 保持容器体积不变,充入一定量的Z,X的体积分数增大

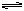 B(g)+xC(g),反应达到平衡时,测得容器内压强增大了p%,若此时A.的转化率为a%,下列关系正确的是: A.若x=1,则p>a 若x=2,则p<a 若x=3,则p=a 若x=4,则p≥a
B(g)+xC(g),反应达到平衡时,测得容器内压强增大了p%,若此时A.的转化率为a%,下列关系正确的是: A.若x=1,则p>a 若x=2,则p<a 若x=3,则p=a 若x=4,则p≥a
 (g)+ xC(g)。达平衡后,测得容器内的压强增大了p%,A.的平衡转化率为a%,则下列推断中正确的是 A.若x=1,则p>aB.若x=2,则p < a 若x=3,则p=a 若x=4,则p≥a
(g)+ xC(g)。达平衡后,测得容器内的压强增大了p%,A.的平衡转化率为a%,则下列推断中正确的是 A.若x=1,则p>aB.若x=2,则p < a 若x=3,则p=a 若x=4,则p≥a