你可能感兴趣的试题
T2′=T2,V2′=V2,S2′=S2 T2′>T2,V2′T2′>T2,V2′>V2,S2′>S2 T2′
密度之比1:2:3 质子数之比6:3:2 中子数之比0:3:4 体积之比1:2:3
质量之比为1:1:1 体积之比为4:14:13 密度之比为13:13:14 原子个数之比为1:1:2
T1<T2 T1℃时该反应的平衡常数为4.0 L.2·mol-2 同一温度下,n(H2)/n(CO)越大,平衡常数也越大 相同条件下n(H2)/n(CO)越大,CO和H2的转化率也越大 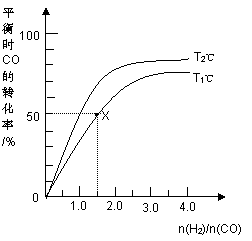
质量相等密度不等的N2和C2H4 等体积等密度的CO和C2H4 等温、等压,等体积的O2和N2 标准状况下,等质量的NO和CO
质量相等、密度不等的N2和C2H4 等体积等密度的CO和C2H4 等温等体积的O2和N2 等压等体积的N2和CO2
密度之比1:2:3 质子数之比6:3:2 中子数之比0:3:4 体积之比6:3:2
若容器内气体的密度不再发生变化,则说明反应达到平衡状态 若t1=20 s,则从t0~t1内的平均反应速率v(NH3)=0.01 mol·L-1·s-1 图2中,t2时改变的条件是降低温度,t3时改变的条件是增大压强 若t2时,再向容器中加入1.4 mol NH3、0.8 mol H2,则平衡将正向移动
液体等温蒸发 气体绝热可逆膨胀 理想气体在等温下混合 等温等压下的化学反应
T1>T2,ΔH>0 T1>T2,ΔH<0 T10 T1
H1/H2=D1/D2 H1/H2=(D1/D2)2 H1/H2=(D1/D2)3 H1/H2=(D1/D2)4
温度相同、体积相同的氧气和氮气分子数相同 等温等压下,二氧化硫气体与二氧化碳气体的密度之比等于16∶11 温度和容积相同的两气罐中分别盛有5 mol氧气和2 mol氮气,两容积中的压强之比等于5∶2 等温等压条件下,5 mol氧气和2 mol 氢气的体积之比等于5∶2
4 3 2 1 
等温等压条件下,5 mol O2(g)和2 mol H2(g)的体积之比等于5∶2 等温等压下,SO2气体与CO2气体的密度之比等于16∶11 温度和容积相同的两气罐中分别盛有5 mol O2(g)和2 mol N2(g),压强之比等于5∶2 温度相同、体积相同的O2(g)和N2(g)分子数相同
质量相等的N2和CO 体积相等的CO和C2H4 等温、等体积的O2和N2 等压、等体积的N2和CO2

