你可能感兴趣的试题
CH4-O2燃料电池 C2H5OH-O2燃料电池 H2-O2燃料电池 CO-O2燃料电池
a为CH4,b为CO2 CO32﹣向正极移动 此电池在常温时也能工作 正极电极反应式为:O2+2CO2+4e﹣=2CO32﹣
负极反应式为CH4 + 10OH--8e-=== CO32-+ 7H2O 正极反应式为O2 + 2H2O + 4e-=== 4OH- 随着不断放电,电解质溶液碱性不变 甲烷燃料电池的能量利用率比甲烷燃烧的能量利用率大
O2—CH4燃料电池 O2—C2H5OH燃料电池 O2—H2燃料电池 O2—CO燃料电池
O2—CH4燃料电池 O2—C2H5OH燃料电池 O2—H2燃料电池 O2—CO燃料电池
负极反应式:O2+2H2O+4e-===4OH- 负极反应式:CH4+8OH--8e-===CO2+6H2O 随着放电的进行,溶液的c(OH-)不变 放电时溶液中的阴离子向负极移动
CH4—O2燃料电池 C2H5OH—O2燃料电池 H2—O2燃料电池 CO—O2燃料电池
负极反应为CH4+10OH-→CO32-+7H2O+8e- 负极反应为O2+2H2O+4e-→4OH- 随着放电进行,溶液中的阳离子向负极移动 随着放电进行,溶液的PH不变
负极反应式为CH4 + 10OH--8e-=== CO32-+ 7H2O 正极反应式为O2 + 2H2O + 4e-=== 4OH- 随着不断放电,电解质溶液碱性不变 甲烷燃料电池也可以用稀硫酸做电解质溶液
负极反应式为:CH4+10OH--8e=CO32-+7H2O 负极反应式为:O2+2H2O+4e=4OH- 随着放电的进行,溶液的pH不变 放电时溶液中的阴离子向正极移动
随着反应的进行,电解质溶液的pH保持不变 负极的电极反应式为CH4+10OH--8e-===CO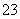 +7H2O 通入氧气的一极发生还原反应,通入甲烷的一极发生氧化反应 甲烷燃料电池的能量利用率比甲烷燃烧的大
+7H2O 通入氧气的一极发生还原反应,通入甲烷的一极发生氧化反应 甲烷燃料电池的能量利用率比甲烷燃烧的大
负极反应为:O2+2H2O+4e— ==4OH-; 负极反应为:CH4+10OH- - 8e—==CO32—+7H2O 放电时溶液中的阳离子向负极移动; 随放电的进行,溶液的pH值不变
负极反应为O2 + 2H2O + 4e = 4OH- 负极反应为 CH4 + 10OH- -8e- = CO32- +7H2O 放电时溶液中的阴离子向负极移动; 随放电的进行,溶液的pH值不变。
碱性燃料电池 磷酸燃料电池 熔融碳酸盐燃料电池 固态氧化物燃料电池 质子交换膜燃料电池

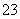 +7H2O 通入氧气的一极发生还原反应,通入甲烷的一极发生氧化反应 甲烷燃料电池的能量利用率比甲烷燃烧的大
+7H2O 通入氧气的一极发生还原反应,通入甲烷的一极发生氧化反应 甲烷燃料电池的能量利用率比甲烷燃烧的大