你可能感兴趣的试题
负极的电极反应式为:CH4—8e-+10OH-=CO32-+7H2O 负极的电极反应式为:4OH-—4e-=2H2O+O2↑ 标准状况下,通入5.6 LO2并完全反应后,有2.00mol电子转移 放电一段时间后,通入O2的电极附近溶液的pH降低
通氧气的铂极为负极 此电池反应为CH4+2O2=CO2+2H2O 此电池放电时,KOH浓度减小 此电池放电时,KOH浓度不变
2.5~3.5mm 3.5~4mm 2~2.5mm 4~5mm
通甲烷的一极为负极,通氧气的一极为正极 放电时通入氧气的一极附近溶液的pH升高 放电一段时间后,KOH的物质的量不发生变化 通甲烷的电极反应式是:CH4+10OH --8e-==CO32-+7H2O
通入甲烷的电极为电池的正极,通入氧气的电极为负极 在标准状况下,每消耗5.6L. O2,可向外提供9.6×104 C的电量 通入甲烷电极的电极反应为:CH4+10OH― ― 8e-=== CO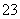 + 7H2O 放电一段时间后,溶液pH升高
+ 7H2O 放电一段时间后,溶液pH升高
负极的电极反应式为:CH4-8e-+10OH-=CO32-+7H2O 负极的电极反应式为:4OH-―4e-=2H2O+O2↑ 标准状况下,通入5.6 LO2并完全反应后,有1.00mol电子转移 放电一段时间后,通入O2的电极附近溶液的pH降低
B.两根石墨棒作电极电解AgNO3溶液,通电tmin时,在 极上共产生11.2mL(标准状况下)气体。然后将电极A.B.与电源反接,用相同的电流再电解0.5tmin,两极上均无气体产生,最终溶液的体积为200mL,则该溶液的pH接近于( ) A.2B.2.7 3 4
通甲烷的一极为负极,通氧气的一极为正极 放电时通入氧气的一极附近溶液的pH升高 放电一段时间后,KOH的物质的量不发生变化 通甲烷的电极反应式是:CH4+10OH --8e-==CO32-+7H2O
负极的电极反应式为:CH4-8e-+10OH-=CO32-+7H2O 负极的电极反应式为:4OH--4e-=2H2O+O2↑ 标准状况下,通入5.6 LO2并完全反应后,有0.50mol电子转移 放电一段时间后,通入O2的电极附近溶液的pH降低
通以甲烷的X极为负极
通电一段时间后,电解质溶液中KOH的物质的量改变
在标准状况下,通过5.6L氧气,完全反应后有1.0mol电子转移
电池的总反应式为CH4+2O2=CO2+2H2O
通入CH3OH的电极为负极 随着放电的进行,负极附近溶液PH上升 每消耗1molCH3OH可以向外电路提供6mole- 通入氧气的一极的电极反应为4H2O + 2O2 + 8e- = 8OH-
X.极为负极,Y.极为正极 工作一段时间后,KOH的物质的量不变 在标准状况下通入5.6LO2完全反应,则有1.0mol电子发生转移 该电池工作时甲烷一极附近溶液的pH降低
通甲烷的一极为负极,通氧气的一极为正极 放电时,通入O2一极附近溶液的pH升高 放电一段时间后,KOH的物质的量不发生变化 通甲烷极的电极反应式是:CH4+10OH--8e-===CO32-+7H2O
通甲烷的一极为负极,通氧气的一极为正极 放电时通入氧气的一极附近溶液的pH升高 放电一段时间后,KOH的物质的量不发生变化 通入甲烷一极的电极反应式是:CH4+10OH --8e-=CO32-+7H2O
X.为负极,Y.为正极 工作一段时间后,KOH的物质的量减少 在标准状况下,通入 5.6 L O2完全反应后,有1 mol电子发生转移 该电池工作时,X.极附近溶液的碱性增强

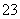 + 7H2O 放电一段时间后,溶液pH升高
+ 7H2O 放电一段时间后,溶液pH升高