你可能感兴趣的试题
用图①装置精炼铜,a极为粗铜,b为精铜,电解质溶液为CuSO4溶液 图②装置的盐桥中KCl的Cl—移向甲烧杯 图③装置中钢闸门应与外接电源的负极相连获得保护 装置④中Ag电极发生反应:2H2O + 2e- = H2↑+ 2OH-
用甲图装置电解精炼铝 乙图中酸性KMnO4溶液中出现气泡,且颜色逐渐褪去 丙图装置可制得金属锰,用同样的装置可制得金属铬 丁图装置中的铁钉几乎没被腐蚀
用图①装置精炼铜,a极为粗铜,b为精铜,电解质溶液为CuSO4溶液 图②装置的盐桥中KCl的Cl—移向乙烧杯 图③装置中钢闸门应与外接电源的负极相连获得保护 图④两个装置中通过导线的电子数相同时,消耗负极材料的物质的量不同
装置①中,Cu为正极,Zn为负极 装置②充满水气体由X.进入可用于收集NO 装置③可用于NH3、HBr的吸收 装置④可用于制乙炔或氢气
用装置①精炼铜,则a极为粗铜,电解质溶液为CuSO4溶液 装置②的总反应是:Cu+2Fe3+=Cu2++2Fe2+ 装置③中钢闸门应与外接电源的负极相连 装置④中的铁钉几乎没被腐蚀
用图①装置精炼铜,a极为粗铜,b为精铜,电解质溶液为CuSO4溶液 图②装置的盐桥中KCl的Cl-移向乙烧杯 图③装置中钢闸门应与外接电源的负极相连获得保护 图④两个装置中通过导线的电子数相同时,消耗负极材料的物质的量不同
实验室常用装置①制取NH3 装置②中X.若为CCl4,可用于吸收NH3,并防止倒吸 装置③可用于制备Fe(OH)2并较长时间观察其白色 装置④可用于收集NO
用装置①精炼铜,则a极为粗铜,电解质溶液为CuSO4溶液 用图②装置实验室制备白色Fe(OH)2 装置③中钢闸门应与外接电源的正极相连 装置④中电子由Zn流向Fe,Zn极发生氧化反应
用装置①精炼铜,则a极为粗铜,电解质溶液为CuSO4溶液 装置②的总反应是:Cu+2Fe3+=Cu2++2Fe2+ 装置③中钢闸门应与外接电源的负极相连 装置④中的铁钉几乎没被腐蚀
用装置①精炼铜,则a极为粗铜,电解质溶液为CuSO4溶液 用图②装置实验室制备白色Fe(OH)2 装置③中钢闸门应与外接电源的正极相连 装置④中电子由Zn流向Fe,Zn极发生氧化反应
用图①装置精炼铜,a极为粗铜,b为精铜,电解质溶液为CuSO4溶液 图②装置的盐桥中KCl的Cl—移向甲烧杯 图③装置中钢闸门应与外接电源的负极相连获得保护 装置④中Ag电极发生反应:2H2O + 2e- = H2↑+ 2OH-
用装置①精炼铜,则a极为粗铜,电解质溶液为CuSO4溶液 装置②的总反应是:Cu+2Fe3+=Cu2++2Fe2+ 装置③中钢闸门应与外接电源的负极相连 装置④中的铁钉几乎没被腐蚀
用图①装置精炼铜,a极为粗铜,b为精铜,电解质溶液为CuSO4溶液 图②装置的盐桥中KCl的Cl—移向甲烧杯 图③装置中钢闸门应与外接电源的负极相连获得保护 装置④中Ag电极发生反应:2H2O + 2e- = H2↑+ 2OH- 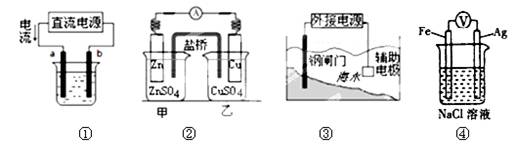
用装置①精炼铜,则a极为粗铜,电解质溶液为CuSO4溶液 用装置①进行电镀,镀件接在b极上 装置②的总反应是:Cu+2Fe3+===Cu2++2Fe2+ 装置③中的铁钉几乎没被腐蚀
用装置①精炼铜,则a极为粗铜,电解质溶液为CuSO4溶液 用装置①进行电镀,镀件接在b极上 装置②的总反应是:Cu+2Fe3+═Cu2++2Fe2+ 装置③中的铁钉几乎没被腐蚀
用甲图装置电解精炼铝 乙图中酸性KMnO4溶液中出现气泡,且颜色逐渐褪去 丙图装置可制得金属锰,用同样的装置可制得金属铬 丁图装置中的铁钉几乎没被腐蚀
装置①中,d为阴极、c为阳极 装置②可用于收集H2、CO2、HCl、NO2等气体(必要时可添加尾气处理装置) 装置③中X.若为四氯化碳,可用于吸收氨气或氯化氢,并能防止倒吸 装置④中可用于干燥、收集氯化氢,并吸收多余的氯化氢
用装置①精炼铜,则a极为粗铜,电解质溶液为CuSO4溶液 装置②的总反应是:Cu+2Fe3+===Cu2++2Fe2+ 装置③中钢闸门应与外接电源的负极相连 装置④中的铁钉几乎没被腐蚀
用装置①精炼铜,则a极为粗铜,电解质溶液为CuSO4溶液 装置②的总反应是:Cu+2Fe3+=Cu2++2Fe2+ 装置③中钢闸门应与外接电源的负极相连 装置④中的铁钉几乎没被腐蚀
用装置①精炼铜,则a极为粗铜,电解质溶液为CuSO4溶液 装置②的总反应是:Cu+2Fe3+=Cu2++2Fe2+ 装置③中钢闸门应与外接电源的负极相连 装置④中的铁钉几乎没被腐蚀

