
 )>c(NH
)>c(NH ) 两种醋酸溶液的物质的量浓度分别为c1和c2,pH分别为a和a+1,则c1=10c2 pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,滴入石蕊溶液呈红色 向0.1 mol/L的氨水中加入少量硫酸铵固体,溶液PH值增大
) 两种醋酸溶液的物质的量浓度分别为c1和c2,pH分别为a和a+1,则c1=10c2 pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,滴入石蕊溶液呈红色 向0.1 mol/L的氨水中加入少量硫酸铵固体,溶液PH值增大
 增大 室温下,将稀氨水逐滴加入稀硫酸中,当溶液pH=7时,c(SO42-)=c(NH4+)
增大 室温下,将稀氨水逐滴加入稀硫酸中,当溶液pH=7时,c(SO42-)=c(NH4+)
 增大
增大
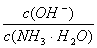 增大
增大
 增大
增大
 增大 两种醋酸溶液的物质的量浓度分别为c1和c2,pH分别为a和a+1,则c1=10c2 常温下,将pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,滴入石蕊呈蓝色 将稀氨水逐滴加入稀硫酸中,当溶液pH=7时,c(SO42-)>c(NH4+)
增大 两种醋酸溶液的物质的量浓度分别为c1和c2,pH分别为a和a+1,则c1=10c2 常温下,将pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,滴入石蕊呈蓝色 将稀氨水逐滴加入稀硫酸中,当溶液pH=7时,c(SO42-)>c(NH4+)
 增大 室温下,将稀氨水逐滴加入稀硫酸中,当溶液pH=7时,c(
增大 室温下,将稀氨水逐滴加入稀硫酸中,当溶液pH=7时,c( )=c(
)=c( )
)
 增大
增大
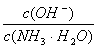 增大
增大
 增大
增大
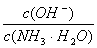 增大
增大
 )>c(Cl-)>c(OH-)>c(H+) 某温度下,Ba(OH)2溶液中KW=10-12,向pH=8的该溶液中加入等体积pH=4的盐酸,混合溶液pH=6 常温下,向10 mL pH=12的NaOH溶液中加入pH=2的HA至pH=7,所得溶液的总体积V≥20 mL
)>c(Cl-)>c(OH-)>c(H+) 某温度下,Ba(OH)2溶液中KW=10-12,向pH=8的该溶液中加入等体积pH=4的盐酸,混合溶液pH=6 常温下,向10 mL pH=12的NaOH溶液中加入pH=2的HA至pH=7,所得溶液的总体积V≥20 mL