
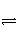
 2H++Y2- HY-的水解方程式:HY-+H2O
2H++Y2- HY-的水解方程式:HY-+H2O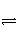
 H3O++Y2- 该酸式盐溶液中离子浓度关系:[Na+]>[HY-]>[OH-]>[H+] 该酸式盐溶液中离子浓度关系:[Na+]>[Y2-]>[HY-]>[OH-]>[H+]
H3O++Y2- 该酸式盐溶液中离子浓度关系:[Na+]>[HY-]>[OH-]>[H+] 该酸式盐溶液中离子浓度关系:[Na+]>[Y2-]>[HY-]>[OH-]>[H+]
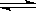 2H++Y2- 在该盐的溶液里,离子浓度为:c(Na+)>c(Y2-)>c(HY-)>c(OH-)>c(H+) 在该盐的溶液里,离子浓度为:c(Na+)>c(HY-) >c(H+) >c(Y2-) HY水解的化学方程式为HY-+H2O
2H++Y2- 在该盐的溶液里,离子浓度为:c(Na+)>c(Y2-)>c(HY-)>c(OH-)>c(H+) 在该盐的溶液里,离子浓度为:c(Na+)>c(HY-) >c(H+) >c(Y2-) HY水解的化学方程式为HY-+H2O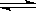 H3O++Y2-
H3O++Y2-
 HY- + H3O+
HY- + H3O+ Y2 -+ H3O+
Y2 -+ H3O+
 2H++Y2― 该酸式盐溶液中离子浓度关系:c(H+)+c(Na+)=c(OH―)+c(Y2―)+c(HY―) 该酸式盐溶液中离子浓度关系:c(H+)+ c(H2Y) =c(OH―)+c(Y2―) 该酸式盐溶液中离子浓度大小关系: c(Na+)> c(OH―)> c(H+)>c(HY―)
2H++Y2― 该酸式盐溶液中离子浓度关系:c(H+)+c(Na+)=c(OH―)+c(Y2―)+c(HY―) 该酸式盐溶液中离子浓度关系:c(H+)+ c(H2Y) =c(OH―)+c(Y2―) 该酸式盐溶液中离子浓度大小关系: c(Na+)> c(OH―)> c(H+)>c(HY―)

 2H++Y2- HY-的水解方程式:HY-+H2O
2H++Y2- HY-的水解方程式:HY-+H2O
 H3O++Y2- 该酸式盐溶液中离子浓度关系:[Na+]>[HY-]>[OH-]>[H+] 该酸式盐溶液中离子浓度关系:[Na+]>[Y2-]>[HY-]>[OH-]>[H+]
H3O++Y2- 该酸式盐溶液中离子浓度关系:[Na+]>[HY-]>[OH-]>[H+] 该酸式盐溶液中离子浓度关系:[Na+]>[Y2-]>[HY-]>[OH-]>[H+]
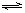 HY-+H3O+
HY-+H3O+ OH-+ H2Y
OH-+ H2Y
 HY-+H3O+ 常温下,该酸式盐的水溶液中溶液中,各离子浓度大小关系为:c(Na+)>c(Y2-)>c(HY-)>c(OH-)>c(H+) 常温下,酸式盐NaHY 的水溶液呈酸性 HY-的水解方程式为:HY-+ H2O
HY-+H3O+ 常温下,该酸式盐的水溶液中溶液中,各离子浓度大小关系为:c(Na+)>c(Y2-)>c(HY-)>c(OH-)>c(H+) 常温下,酸式盐NaHY 的水溶液呈酸性 HY-的水解方程式为:HY-+ H2O H3O++Y2-
H3O++Y2-
 HY-+H3O+ 常温下,该酸式盐的水溶液中溶液中,各离子浓度大小关系为:c(Na+)>c(Y-)>c(HY-)>c(OH-)>c(H+) 常温下,酸式盐NaHY 的水溶液呈酸性 HY-的水解方程式为:HY-+ H2O
HY-+H3O+ 常温下,该酸式盐的水溶液中溶液中,各离子浓度大小关系为:c(Na+)>c(Y-)>c(HY-)>c(OH-)>c(H+) 常温下,酸式盐NaHY 的水溶液呈酸性 HY-的水解方程式为:HY-+ H2O H3O++Y2-
H3O++Y2-
 HY-+H3O+ 在该盐的溶液中,离子浓度为: (Na+)>C.(Y2-)>C.(HY-)>C.(OH-)>C.(H+) C.在该盐的溶液中,离子浓度为:C.(Na+)>C.(HY-)>C.(Y2-)>C.(OH-)>C.(H+) HY-水解方程式为:HY-+H2O
HY-+H3O+ 在该盐的溶液中,离子浓度为: (Na+)>C.(Y2-)>C.(HY-)>C.(OH-)>C.(H+) C.在该盐的溶液中,离子浓度为:C.(Na+)>C.(HY-)>C.(Y2-)>C.(OH-)>C.(H+) HY-水解方程式为:HY-+H2O Y2-+H3O+
Y2-+H3O+
 2H3O++Y2- 在该酸式盐溶液中c(Na+)>c(Y2-)>c(H.Y-)>c(OH-)>c(H.+) H.Y-的水解方程式为H.Y-+H2O
2H3O++Y2- 在该酸式盐溶液中c(Na+)>c(Y2-)>c(H.Y-)>c(OH-)>c(H.+) H.Y-的水解方程式为H.Y-+H2O H3O++Y2- 在该酸式盐溶液中c(Na+)>c(H.Y-)>c(OH-)>c(H.+)
H3O++Y2- 在该酸式盐溶液中c(Na+)>c(H.Y-)>c(OH-)>c(H.+)
 Y2-+H3O+ 若HY-能电离,电离方程式为HY-+H2O
Y2-+H3O+ 若HY-能电离,电离方程式为HY-+H2O Y2-+H3O+
Y2-+H3O+
 Y2-+H3O+ 若HY-能电离,电离方程式为HY-+H2O
Y2-+H3O+ 若HY-能电离,电离方程式为HY-+H2O Y2-+H3O+
Y2-+H3O+
 2H++Y2- HY-的水解方程式:HY-+H2O
2H++Y2- HY-的水解方程式:HY-+H2O H3O++Y2- 该酸式盐溶液中离子浓度关系:[Na+]>[HY-]>[OH-]>[H+] 该酸式盐溶液中离子浓度关系:[Na+]>[Y2-]>[HY-]>[OH-]>[H+]
H3O++Y2- 该酸式盐溶液中离子浓度关系:[Na+]>[HY-]>[OH-]>[H+] 该酸式盐溶液中离子浓度关系:[Na+]>[Y2-]>[HY-]>[OH-]>[H+]