你可能感兴趣的试题
含多个电子的原子中,能量高的电子在离核近的区域运动 每个电子层最多容纳的电子数是2n2个 最外层电子数不超过8个(第1层为最外层时,电子数不超过2个) 核外电子是分层排布的,元素的化学性质与原子的最外层电子排布密切相关
原子核外电子排布式为1s2的原子与原子核外电子排布式为1s22s2的原子化学性质相似 Fe3+的最外层电子排布式为3s23p63d5 基态铜原子的最外层的电子排布图:  所有非金属元素都分布在p区
所有非金属元素都分布在p区
电子离核越近,能量越高 原子核外电子的运动没有规律 在多电子原子中,核外电子分层排布 电子一般尽可能排布在能量高的电子层中
电子云是笼罩在原子核外的云雾 下列电子排布式:1s22s12p1 是某原子基态的排布式 任何能层中的d能级的轨道数都为5 [Ar]3d64s2表示的是Fe原子的电子排布式
正确,符合核外电子排布规律 错误,违背了“能量最低原理” 错误,违背了“泡利原理” 错误,违背了“洪特规则”
第一电离能的周期性递变规律是原子半径、化合价、电子排布周期性变化的结果
通常元素的第一电子亲和能为正值,第二电子亲和能为负值
电负性是相对的,所以没有单位
金属元素的电负性较大,非金属元素的电负性较小
在一个原子里找不到两个能量基本相同的电子 在L.层运动的电子能量一定比M.层运动的电子能量要大 第一电离能与电负性呈周期性变化取决于元素原子核外电子排布的周期性变化 根据各电子层最多容纳电子数目是2n2的规律,钾原子的M.层应有2×32个电子
质子数为10 单质具有还原性 是单原子分子 电子数为10
元素性质的周期性变化是指原子半径、元素的主要化合价及原子核外电子排布的周期性变化 元素性质的周期性变化决定于元素原子核外电子排布的周期性变化 从Li—→F,Na—→Cl,元素的最高化合价均呈现从+1价—→+7价的变化 电子层数相同的原子核外电子排布,其最外层电子数均从1个到8个呈现周 期性变化
原子核外电子排布式为1s2的原子与原子核外电子排布式为1s22s2的原子化学性质相似 Fe3+的最外层电子排布式为3s23p63d5 基态铜原子的价电子排布图:
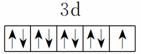 基态碳原子的价电子排布图:
基态碳原子的价电子排布图: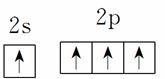
原子核外电子排布式为1s2的原子与原子核外电子排布式为1s22s2的原子化学性质相似 Fe3+的最外层电子排布式为3s23p63d5 基态铜原子的价电子排布图: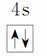
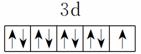 基态碳原子的价电子排布图:
基态碳原子的价电子排布图: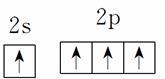
第一电离能的周期性递变规律是原子半径、化合价、电子排布周期性变化的结果 通常元素的第一电离能为正值,第二电离能为负值 电负性是相对的,所以没有单位 分析元素电负性数值可以看出,金属元素的电负性较大,非金属元素的电负性较小
核外电子总是尽先占据能量最低的轨道 在同一个原子中,不可能有运动状态完全相同的两个电子存在 核外电子总是尽先占据能量最高的轨道 在同一个原子中,可能有运动状态完全相同的两个电子存在
原子核外电子排布式为1s2的原子与原子核外电子排布式为1s22s2的原子化学性质相似 Fe3+的最外层电子排布式为3s23p63d5 基态铜原子的最外层的电子排布图:  所有非金属元素都分布在p区
所有非金属元素都分布在p区
p区元素全部都是主族元素 稀有气体的原子的电子排布最外层都是以P6结束 主族元素的原子核外电子最后填入的能级是s能级或p能级 核外电子排布相同的微粒,一定具有相同的化学性质
表示两种元素 核外电子排布相同 都有相对稳定结构 核外都有2个电子层
主族元素的原子核外电子最后填入的能级是s能级 主族元素的原子核外电子最后填入的能级是s能级或p能级 主族元素的原子核外电子最后填入的能级是d能级或f能级 主族元素的原子核外电子最后填入的能级是s能级或d能级
原子核外电子排布式为1s2的原子与原子核外电子排布式为1s22s2的原子化学性质相似 Fe3+的最外层电子排布式为3s23p63d5 基态铜原子的价电子排布图: 基态碳原子的价电子排布图:
基态碳原子的价电子排布图:

 所有非金属元素都分布在p区
所有非金属元素都分布在p区

 基态碳原子的价电子排布图:
基态碳原子的价电子排布图:

 基态碳原子的价电子排布图:
基态碳原子的价电子排布图:
 所有非金属元素都分布在p区
所有非金属元素都分布在p区
 基态碳原子的价电子排布图:
基态碳原子的价电子排布图: