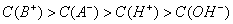你可能感兴趣的试题
若混合后所得溶液呈中性,则HA肯定是强酸、BOH肯定是强碱 若混合前酸、碱物质的量浓度相同,混合后所得溶液呈酸性,则HA肯定是弱酸 若混合前酸、碱pH之和等于14,混合后所得溶液呈碱性,则BOH肯定是弱碱 若混合后所得溶液呈酸性,则混合溶液中离子浓度一定满足: 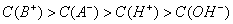
在酸性条件下 在中性条件下 在强碱性下加热后 硼砂溶液及碱溶液中 弱酸性条件
酸碱中和生成盐水,而盐水解又生成酸和碱,所以说,酸碱中和反应都是可逆的 某溶液呈中性(PH=7),这种溶液一定不含水解的盐 强酸强碱生成的盐水解呈中性 强酸弱碱所生成的盐的水溶液呈酸性
碱性和中性;酸性 酸性;碱性和中性 碱性;酸性和中性 酸性和中性;碱性
酸式盐的溶液一定显酸性 只要酸与碱的物质的量浓度和体积分别相同,它们反应后的溶液就呈中性 纯水呈中性是因为水中氢离子的物质的量浓度和氢氧根离子的物质的量浓度相等 碳酸溶液中氢离子物质的量浓度是碳酸根离子物质的量浓度的二倍
溶液呈中性的盐一定是强酸强碱生成的盐 所有盐溶液中c(H+)=c(OH-) 盐溶液的酸碱性主要决定于形成盐的酸和碱的相对强弱 强酸形成的盐的水溶液一定呈酸性
酸与碱的物质的量相等 酸提供的H+与碱提供的OH-的物质的量相等 酸溶液中的C(H+)与碱溶液中的OH-相等 溶液一定呈中性
氨基酸在酸性溶液中称为酸性氨基酸 氨基酸在碱性溶液中称为碱性氨基酸 氨基酸在中性溶液中称为中性氨基酸 以上叙述都对 以上叙述都错
对羟基苯甲酸酯类,商品名为尼泊金,乙酯、丙酯、丁酯等合用有协同作用 对羟基苯甲酸酯类中酸性、中性溶液中均有效,在弱碱性溶液中作用减弱 苯扎溴铵又名新洁尔灭,为阴离子表面活性剂,也可作为防腐剂 苯甲酸在酸性溶液中抑菌效果较好,最适pH值是4 山梨酸起防腐作用的是未解离的分子,在pH值为4的水溶液中效果较好
能使石蕊试液变蓝的溶液一定是碱溶液 可用酚酞试液鉴别酸性溶液和中性溶液 pH小于7的溶液是酸的溶液 碱溶液一定是碱性溶液
在酸性条件 在中性条件 在强碱性下加热后 硼砂溶液及碱溶液中 弱酸性条件
pH<7一定是酸的溶液 pH>7 一定是碱的溶液 pH=7一定是盐的溶液 盐的溶液可能显酸性、碱性或中性
NaHC0中含有氢,故其水溶液呈酸性 浓HAc(17mol/L)的酸度大于17mol/LH2S04水溶液的酸度 浓度(单位:mol/L)相等的一元酸和一元碱反应后,其溶液呈中性 当[H+]大于[OH-]时,溶液呈酸性 当[H+]大于[OH-]时,溶液呈碱性
酸与碱反应生成盐和水,所以生成盐和水的反应一定是酸与碱的反应 向某溶液中滴加无色酚酞试液,酚酞试液不变色,说明该项溶液一定显酸性 酸和碱的溶液能与指示剂反应,所以所有的酸和碱都能使指示剂变色 盐酸溶液、硫酸溶液都能使石蕊试液变红,所以硝酸溶液也能使石蕊试液变红
酸溶液的物质的量浓度大于碱溶液 酸溶液中H+的浓度大于碱溶液中OH-的浓度 酸溶液的物质的量浓度等于碱溶液 酸溶液中H+的浓度小于碱溶液中OH-的浓度