
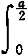 [f(x)+f(x-a)]dx
[f(x)+f(x-a)]dx 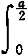 [f(x)+f(a-x)]dx
[f(x)+f(a-x)]dx 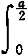 [f(x)-f(a-x)]dx
[f(x)-f(a-x)]dx 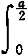 [f(x)-f(x-a)]dx
[f(x)-f(x-a)]dx
 f(x)dx=2
f(x)dx=2 f(x)dx 若f(-x)=-f(x),则有
f(x)dx 若f(-x)=-f(x),则有 f(x)dx=0
f(x)dx=0  f(x)dx=
f(x)dx= [f(x)-f(-x)]dx
[f(x)-f(-x)]dx  f(x)dx=
f(x)dx= [f(x)+f(-x)]dx
[f(x)+f(-x)]dx
 F′(x)dx=f(x)+c
F′(x)dx=f(x)+c  f(x)dx=F(x)+c
f(x)dx=F(x)+c  F(x)dx=f(x)+c
F(x)dx=f(x)+c  f′(x)dx=F(x)+c
f′(x)dx=F(x)+c
 f(x)dx=f(x) d
f(x)dx=f(x) d f(x)dx=f(x)dx (d/dx)
f(x)dx=f(x)dx (d/dx) f(x)dx=f(x)+c (d/dx)
f(x)dx=f(x)+c (d/dx) f(x)dx=f(x)dx
f(x)dx=f(x)dx
 ʃ|x2-4|dx ʃ(x2-4)dx+ʃ(x2-4)dx
ʃ|x2-4|dx ʃ(x2-4)dx+ʃ(x2-4)dx
 f(x)dx=f(x)dx (d/dx)
f(x)dx=f(x)dx (d/dx) f(x)dx=f(x)+c d
f(x)dx=f(x)+c d f(x)dx=f(x) (d/dx)
f(x)dx=f(x) (d/dx) f(x)dx=f(x)dx
f(x)dx=f(x)dx