你可能感兴趣的试题
向该混合溶液中逐滴加入NaOH溶液,最先看到红褐色沉淀 向该溶液中加入适量氯水,并调节pH到3~4后过滤,可获得纯净的CuSO4溶液 该溶液中c(SO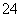 )∶[c(Cu2+)+c(Fe2+)+c(Fe3+)]>5∶4 在pH=5的溶液中Fe3+不能大量存在
)∶[c(Cu2+)+c(Fe2+)+c(Fe3+)]>5∶4 在pH=5的溶液中Fe3+不能大量存在
沉淀-溶解平衡存在与固体难溶电解质的饱和溶液中 沉淀-溶解平衡常数也叫溶度积 任何难溶电解质的溶解和沉淀过程都是可逆的 温度升高,溶度积增大
反应后溶液中不存在任何沉淀,所以反应前后Cu2+的浓度不变 沉淀溶解后,将生成深蓝色的配合离子2+ 向反应后的溶液加入乙醇,没有任何现象,因为2+与乙醇不反应 在2+离子中,Cu2+给出孤对电子,NH3提供空轨道
向该混合溶液中逐滴加入NaOH溶液,最先看到红褐色沉淀 为得到澄清的该混合溶液,配制过程中应加入适量稀硫酸 向该溶液中加入适量氯水,并调节pH到3~4后过滤,可获得纯净的CuSO4溶液 在pH=5的溶液中Fe3+不能大量存在
pH=3时溶液中铁元素的主要存在形式是Fe3+ 若Ni(NO3)2溶液中含有少量的Co2+杂质,可通过调节溶液pH的方法来除去 若分离溶液中的Fe3+和Cu2+,可调节溶液的pH在4左右 若在含有Cu2+和Ni2+的溶液中加入烧碱,Ni(OH)2优先沉淀
难溶电解质都是弱电解质 相同温度下,AgCl在水中的溶解能力与在NaCl溶液中的相同 难溶电解质在水溶液中达到沉淀溶解平衡时,沉淀和溶解即停止 在白色ZnS沉淀上滴加CuSO4溶液,沉淀变黑色,说明CuS比ZnS更难溶于水
溶度积小的沉淀可以转化为溶度积更小的沉淀 若先加入Na2S溶液,再加入KI溶液,则无黄色沉淀产生 25℃时,饱和AgCl、AgI、Ag2S溶液中所含Ag+的浓度相同 25℃时,AgCl固体在等物质的量浓度的NaCl、CaCl2 溶液中的溶度积相同
在pH=5的溶液中,Fe3+不能大量存在 混合溶液中c(SO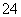 )∶[c(Fe3+)+c(Fe2+)+c(Cu2+)]>5∶4 向混合溶液中逐滴加入0.1 mol·L-1NaOH溶液,最先看到红褐色沉淀 向混合溶液中加入适量氯水,并调节pH到3~4过滤,可获较纯净的CuSO4溶液
)∶[c(Fe3+)+c(Fe2+)+c(Cu2+)]>5∶4 向混合溶液中逐滴加入0.1 mol·L-1NaOH溶液,最先看到红褐色沉淀 向混合溶液中加入适量氯水,并调节pH到3~4过滤,可获较纯净的CuSO4溶液
反应后溶液中不存在任何沉淀,所以反应前后Cu2+的浓度不变 在[Cu(NH3)4] 2+离子中,Cu2+给出孤对电子,NH3提供空轨道 向反应后的溶液加入乙醇,溶液没有发生变化 沉淀溶解后,将生成深蓝色的配合离子[Cu(NH3)4] 2+
反应后溶液中不存在任何沉淀,所以反应前后Ag+的浓度不变 沉淀溶解后,生成的无色配合离子[Ag(NH3)2]+一定难电离 向反应后的溶液中加入过量盐酸,无任何现象发生 在[Ag(NH3)2]+离子中,既存在离子键,又存在共价键
反应后溶液中不存在任何沉淀,所以反应前后Cu2+的浓度不变 沉淀溶解后,将生成深蓝色的配合离子[Cu(NH3)4]2+ 向反应后的溶液中加入乙醇,溶液没有发生变化 在[Cu(NH3)4]2+离子中,Cu2+给出孤对电子,NH3提供空轨道

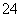 )∶[c(Cu2+)+c(Fe2+)+c(Fe3+)]>5∶4 在pH=5的溶液中Fe3+不能大量存在
)∶[c(Cu2+)+c(Fe2+)+c(Fe3+)]>5∶4 在pH=5的溶液中Fe3+不能大量存在
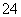 )∶[c(Fe3+)+c(Fe2+)+c(Cu2+)]>5∶4 向混合溶液中逐滴加入0.1 mol·L-1NaOH溶液,最先看到红褐色沉淀 向混合溶液中加入适量氯水,并调节pH到3~4过滤,可获较纯净的CuSO4溶液
)∶[c(Fe3+)+c(Fe2+)+c(Cu2+)]>5∶4 向混合溶液中逐滴加入0.1 mol·L-1NaOH溶液,最先看到红褐色沉淀 向混合溶液中加入适量氯水,并调节pH到3~4过滤,可获较纯净的CuSO4溶液