你可能感兴趣的试题
反应物和生成物的状态 反应物的性质 反应物的多少 反应的快慢;表示反应热的单位
当△H.为“一”时,表示该反应为吸热反应 已知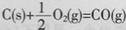 的反应热为l10.5kJ/mol,说明碳的燃烧热为110.5kJ/mol 反应热的大小取决于反应物所具有总能量和生成物所具有总能量的相对大小 反应热不但与反应体系的始态和终点状态有关,而且与反应的途径也有关
的反应热为l10.5kJ/mol,说明碳的燃烧热为110.5kJ/mol 反应热的大小取决于反应物所具有总能量和生成物所具有总能量的相对大小 反应热不但与反应体系的始态和终点状态有关,而且与反应的途径也有关
当∆H为“-”时,表示该反应为吸热反应 已知 (s)+ O2(g)=CO(g)的反应热为-110.5kJ/mol,说明碳的燃烧热为110.5kJ/mol C.反应热的大小与反应物所具有的能量和生成物所具有的能量无关 化学反应的反应热只与反应体系的始态和终点状态有关,而与反应的途径无关
O2(g)=CO(g)的反应热为-110.5kJ/mol,说明碳的燃烧热为110.5kJ/mol C.反应热的大小与反应物所具有的能量和生成物所具有的能量无关 化学反应的反应热只与反应体系的始态和终点状态有关,而与反应的途径无关
10 L 0.05 mol•L﹣1Ba(OH)2溶液与20 L 0.05 mol•L﹣1 HNO3反应时的反应热是中和热
1 mol HCl气体通入1 L 0.01 mol•L﹣1 NaOH溶液中反应时的反应热是中和热
1 mol HClO与2 mol NaOH溶液反应时的反应热也可能是中和热
只要强酸与强碱在稀溶液中反应生成1 mol水时的反应热就是中和热
化学反应的反应热都可以通过实验测定出来 活化能越大的化学反应其反应热数值也越大 反应热的产生是由于生成物与反应物的总能量不同 放热反应是由于反应物键能总和大于生成物键能总和
变换反应速度上升; 变换反应速度上升,反应热下降; 变换反应速度下降,反应热上升; 变换反应速度下降,反应热下降;
基元反应的反应热; 基元反应,分子反应需吸收的能量; 一般反应的反应热; 一般反应,分子反应需吸收的能量。
反应热和焓变的单位都是kJ 如果反应是在恒温恒压条件下进行的,此时的反应热与焓变相等 如果反应是在恒温恒容条件下进行的,此时的反应热与焓变相等 任何化学反应的反应热均可通过实验直接测定
当∆H为“-”时,表示该反应为吸热反应 已知 (s)+ O2(g)=CO(g)的反应热为-110.5kJ/mol,说明碳的燃烧热为110.5kJ/mol C.反应热的大小与反应物所具有的能量和生成物所具有的能量无关 化学反应的反应热只与反应体系的始态和终点状态有关,而与反应的途径无关
O2(g)=CO(g)的反应热为-110.5kJ/mol,说明碳的燃烧热为110.5kJ/mol C.反应热的大小与反应物所具有的能量和生成物所具有的能量无关 化学反应的反应热只与反应体系的始态和终点状态有关,而与反应的途径无关
不管反应是一步完成还是分几步完成,其反应热相同 反应热只与反应体系的始态和终态有关,而与反应的途径无关 有些反应的反应热不能直接测得,可通过盖斯定律间接计算得到 根据盖斯定律,热化学方程式中△H.直接相加即可得总反应热
当∆H为“-”时,表示该反应为吸热反应 已知 (s)+ O2(g)=CO(g)的反应热为110.5kJ/mol,说明碳的燃烧热为110.5kJ C.反应热的大小与反应物所具有的能量和生成物所具有的能量无关 化学反应的反应热只与反应体系的始态和终点状态有关,而与反应的途径无关
O2(g)=CO(g)的反应热为110.5kJ/mol,说明碳的燃烧热为110.5kJ C.反应热的大小与反应物所具有的能量和生成物所具有的能量无关 化学反应的反应热只与反应体系的始态和终点状态有关,而与反应的途径无关
反应物的状态 生成物的状态
反应物的多少 表示反应热的单位
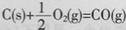 的反应热为l10.5kJ/mol,说明碳的燃烧热为110.5kJ/mol 反应热的大小取决于反应物所具有总能量和生成物所具有总能量的相对大小 反应热不但与反应体系的始态和终点状态有关,而且与反应的途径也有关
的反应热为l10.5kJ/mol,说明碳的燃烧热为110.5kJ/mol 反应热的大小取决于反应物所具有总能量和生成物所具有总能量的相对大小 反应热不但与反应体系的始态和终点状态有关,而且与反应的途径也有关
 O2(g)=CO(g)的反应热为-110.5kJ/mol,说明碳的燃烧热为110.5kJ/mol C.反应热的大小与反应物所具有的能量和生成物所具有的能量无关 化学反应的反应热只与反应体系的始态和终点状态有关,而与反应的途径无关
O2(g)=CO(g)的反应热为-110.5kJ/mol,说明碳的燃烧热为110.5kJ/mol C.反应热的大小与反应物所具有的能量和生成物所具有的能量无关 化学反应的反应热只与反应体系的始态和终点状态有关,而与反应的途径无关
 O2(g)=CO(g)的反应热为-110.5kJ/mol,说明碳的燃烧热为110.5kJ/mol C.反应热的大小与反应物所具有的能量和生成物所具有的能量无关 化学反应的反应热只与反应体系的始态和终点状态有关,而与反应的途径无关
O2(g)=CO(g)的反应热为-110.5kJ/mol,说明碳的燃烧热为110.5kJ/mol C.反应热的大小与反应物所具有的能量和生成物所具有的能量无关 化学反应的反应热只与反应体系的始态和终点状态有关,而与反应的途径无关
 O2(g)=CO(g)的反应热为110.5kJ/mol,说明碳的燃烧热为110.5kJ C.反应热的大小与反应物所具有的能量和生成物所具有的能量无关 化学反应的反应热只与反应体系的始态和终点状态有关,而与反应的途径无关
O2(g)=CO(g)的反应热为110.5kJ/mol,说明碳的燃烧热为110.5kJ C.反应热的大小与反应物所具有的能量和生成物所具有的能量无关 化学反应的反应热只与反应体系的始态和终点状态有关,而与反应的途径无关